서 론
신세포암은 진단 당시 30% 이상의 환자에서 전이를 동반하고, 신장에 국한된 신세포암의 국소치료 후에도 30%의 환자는 전이를 유발하는데, 폐 전이가 가장 많고, 국소 림프절 전이, 뼈 전이, 간 전이 순이다.1) 신세포암의 두경부 전이는 8%~15%의 빈도로 보고되는데,2,3) 갑상선과 이하선이 흔한 부위이며, 피부, 치은, 비강 등의 부위에 전이가 보고되었다.4) 신세포암의 악하선 전이는 국내외에서 12례만이 드물게 보고되었다.4,5)
본 저자들은 16년 전 신세포암으로 신장 적출술 시행 후 악하선 전이를 보인 증례를 경험하였기에 문헌 고찰과 함께 보고하고자 한다.
증 례
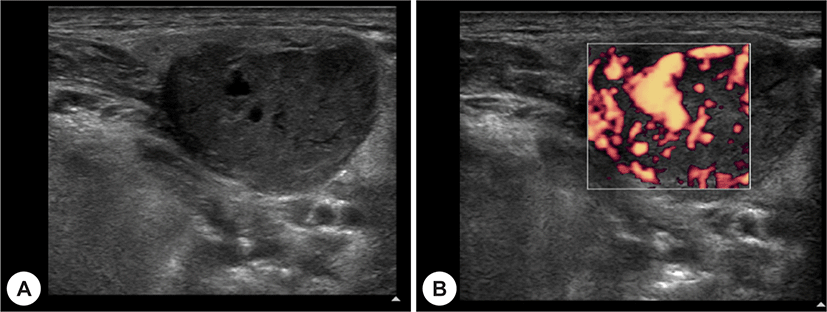
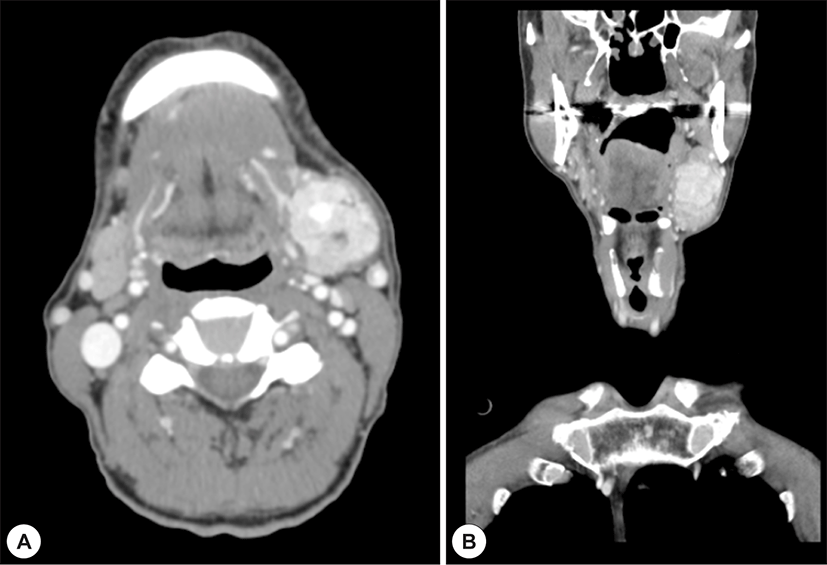
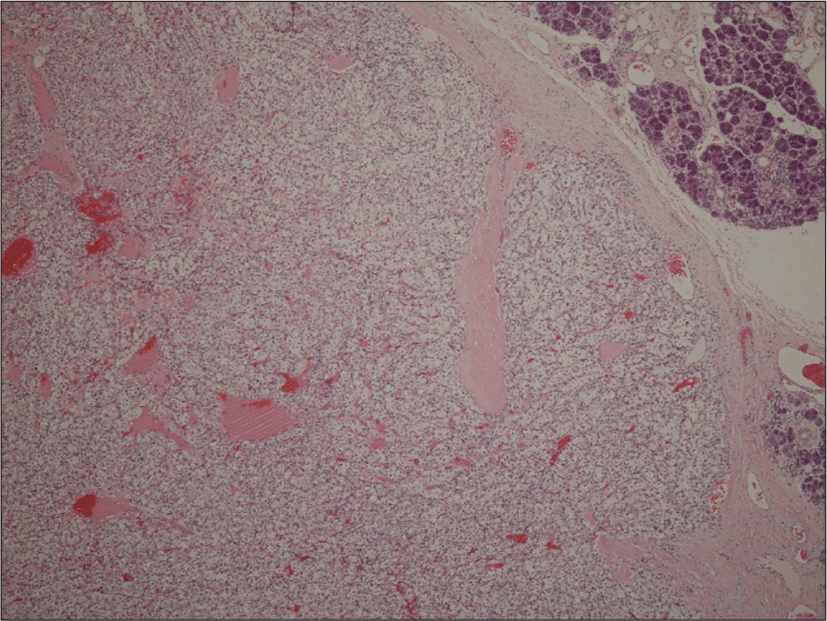
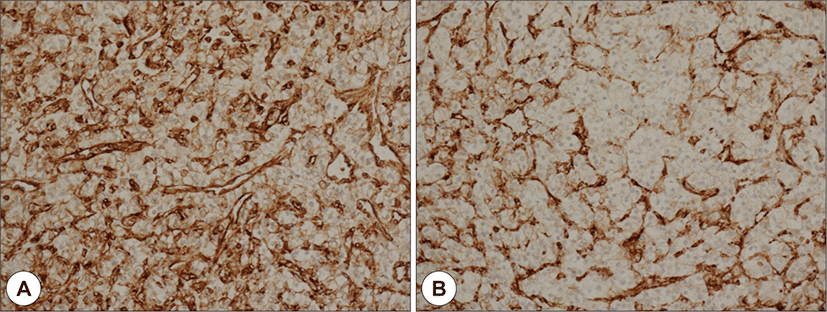
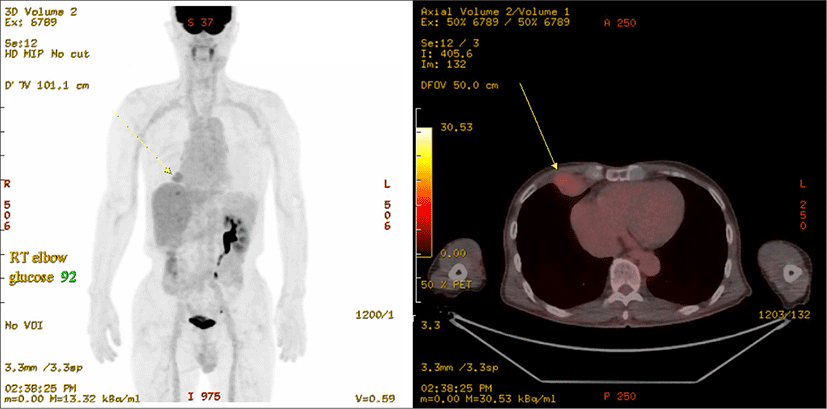
69세 남자 환자가 5년 전부터 시작된 좌측 악하선 부위 종괴의 크기 증가로 인해 주소로 본원 이비인후과에 내원하였다. 과거력상 고혈압, 부정맥이 있었으며, 타병원에서 16년 전 신장 투명세포암종(Renal cell carcinoma, clear cell type)으로 우측 근치적 신장 적출술을 시행한 병력이 있었다. 신체 진찰상 좌측 악하부의 무통성 종괴가 촉지되었다. 경부 초음파에서 경계가 분명한, 저에코의 고형 종괴가 관찰되었으며, 많은 혈관 분포를 가지고 있었다(Fig. 1A and B). 경부 전산화단층촬영상 좌측 악하선 부위에 불균질한 조영 증가를 동반한 4×3 cm의 연부조직 종괴가 관찰되었다(Fig. 2A and B). 초음파 유도 세침흡인검사상 악성세포는 관찰되지 않았다. 악하선 양성종양 의증으로 악하선 절제술을 시행하고, 수술 당시 악하선은 유착소견 없이 잘 박리되었다. 조직학적 검사상 종양은 피막을 형성하고 있었으며, 국소 침윤 소견을 보였고, 유리질화 콜라겐(hyalinized collagen)과 호산구성 분비 물질이 포함된 균일한 투명 세포로 구성되어 있었다(Fig. 3). 투명세포를 포함하는 타액선 원발종양과 전이성 투명세포 종양을 감별하기 위해 면역조직화학 검사를 시행하였고, Vimentin과 CD10에서 양성을 나타냈다(Fig. 4A and B). 신장 투명세포암종의 과거력과 조직소견에 따라 최종적으로 신장 투명세포암종의 악하선 전이로 진단하였다. 수술 후 시행한 양전자방출 단층촬영에서 우측 폐중엽에 강한 신호소견을 보여 흉부외과에서 절제술을 시행하였고(Fig. 5), 조직검사에서 신장 투명세포암종의 전이가 확인되었다.
고 찰
신세포암은 두경부로 전이되는 쇄골하부 원발 종양 중 유방암, 폐암에 이어 세번째로 흔한 빈도를 보인다.2) 신세포암의 전형적인 두경부 전이 경로는 종양색전의 혈행성 전이이고, 흉관을 통한 림프 전이도 가능하다.2,3) 신세포암은 조직학적으로 투명세포, 유두상(papillary), 혐색소성(chromophobe), 집합관(collecting duct) 등으로 나누는데,6) 이중 가장 흔한 투명세포 신세포암이 국소 침윤 및 전이도 가장 많이 발생하는 공격적인 유형이다.1) 유두상 및 혐색소성 신세포암은 신장수술 후 5년 이후에는 전이가 없었지만, 투명세포 신세포암은 신장수술 10년 이후에도 전이가 발생하므로 임상적인 주의가 필요하다.7)
신세포암의 두경부 전이는 일반적으로 비조영제 전단화단층촬영에서 20 하운스필드 이상의 이질적(heterogenous) 병변으로 보이고,3) 조영제를 사용하면 혈관분포와 병변의 범위를 잘 파악할 수 있다.2) 자기공명영상은 신세포암의 두개내 침범과 방사선치료 후 잔존병변을 확인하는데 도움이 된다.2) 혈관조영술은 색전술을 통해 수술 시 출혈 가능성을 감소시키는 역할을 할 수 있다.2) 초음파 검사에서 다양한 에코를 보이지만,3) 타액선 전이는 주로 경계가 분명한 저에코 소견을 보이며, 도플러를 통해 혈관분포를 평가할 수 있다.4) 신세포암 두경부 전이는 여러가지 영상검사에서 혈관이 풍부한 종물 외에는 진단적 특이소견이 없고, 주변침범 소견이 없다면 양성질환으로 오인할 수 있으므로 주의가 필요하겠다.
신세포암의 두경부 전이를 시사하는 세침흡인세포검사 소견은 세포질 공포, 낮은 핵-세포질 비율, 이질적 세포 집단, 혈색소 침착 등의 소견이 있지만,3) 선암, 흑색종, 편편상피암종과의 감별이 필요하며, 신장암의 두경부 전이를 정확하게 진단하기에는 어려움이 있다.3)
신세포암의 타액선 전이는 타액선 원발부 투명세포암종과의 감별이 필요하며, 면역화학조직검사가 도움이 된다.5) 타액선 투명세포암종은 사이토케라틴(CK5, CK7, CK8, CK14, CK19), 상피막항원(EMA), 암배항원(CEA), p63에서 주로 양성이며, vimentin, S-100 protein, smooth-muscle actin, muscle-specific actin, calponin, GFAP에서 음성이고, 투명세포 신세포암은 vimentin, PAX8, CD10의 양성과 CK7의 음성의 특징을 보인다.8)
신세포암의 악하선 전이는 12례가 보고되었다.4-6,9-18) 남자 5명, 여자 7명이었고, 나이는 평균 66.4세(범위 50~97)였다. 임상증상은 8례에서 무통성 악하선 종물 소견을 보였으며, 3례는 통증을 동반하거나 고정된 소견을 보였고, 악하선관을 침범한 1례는 구강내 종물 소견을 보였다. 악하선 종물의 크기는 평균 2.4 cm(범위 0.9~4)였다. 5례는 악하선 외 다른 부위에도 전이를 동반하였다. 9례는 신장암 진단 후 평균 7.3년(범위 1.5~13)이 지난 다음 악하선 전이가 진단되었고, 2례는 악하선 종물이 신장암의 첫 증상이었다. 수술 전 평가에서 신세포암의 악하선 전이를 진단할 수 있었던 것은 3례 뿐이었고, 나머지 9례는 모두 수술 후 조직검사를 통해서 진단하였다(Table 1). 1984년에 보고된 1례는 악하선 수술 직후에는 악하선의 세엽세포암종(acinic cell carcinoma)로 진단하였지만, 5년 후 악하선 부위에 통증을 동반한 종물이 재발했을 때에 비로소 이전의 신장암 수술병력을 인지하고, 병리적학적 재검토 후 신장암의 악하선 전이로 진단을 변경하였다.18)
| Authors | Sex/age | Clinical manifestation | Size of mass | Other site metastasis | PreOP FNA or CNBx | Time after RCC Dx |
|---|---|---|---|---|---|---|
| Smits et al.9) | F/60 | Mobile mass | 3 cm | Parotid | NA | 7.5 years |
| Bedrosian et al.18) | M/61 | Asymptomatic nodule | 0.9 cm | No | NA | 0 years |
| Zoltie10) | F/50 | Tender pulsatile swelling | 1 cm | No | NA | 0 years |
| Ficarra et al.11) | M/73 | Painless lump (mouth) | NA | Bones, lung | NA | 13 years |
| Ham et al.12) | M/59 | Painless mobile mass | 4 cm | No | Chronic inflammation | 3 years |
| Moudouni et al.13) | M/83 | Painless swelling | 4 cm | No | NA | 10 years |
| Miah et al.15) | F/61 | Painless swelling | 3 cm | Thyroid | Pleomorphic adenoma | 7 years |
| Serouya et al.6) | M/60 | Nontender mass | 1 cm | No | Metastatic RCC | 9 years |
| Melloni et al.16) | F/53 | Painful, fixed swelling | 4 cm | No | Warthin's tumor | 4 years |
| Balaban et al.17) | F/66 | Mass | 1.3 cm | Parotid, liver, brain | Metastatic RCC | 1.5years |
| Majewska et al.5) | F/97 | Hard cohesive immobile | NA | NA | NA | NA |
| Higuera et al.4) | F/74 | Mass | 1.5 cm | Omentum, adrenal gland | Metastatic RCC | 11 years |
신세포암의 두경부 전이는 신장 원발부위가 치료되고, 다른 부위의 전이가 없다면 적극적으로 두경부 국소치료를 시도하는 것이 합리적인데,3) 수술이 일차적으로 선택될 수 있다.2,19,20) 수술은 주로 진단 및 감량(debulking)의 역할을 하지만, 신장 적출수술 후 단일 전이병변을 절제했을 경우, 41%의 2년 생존율과 13%의 5년 생존율을 보였으며,3) 두경부 전이의 완전절제는 불완전 절제 또는 비절제와 비교 시 전체생존율(overall survival)이 4년 증가하였다고 메타분석에서 보고하였다.19) 신세포암은 일반적으로 방사선치료에 저항성을 보이지만, 위치에 따라서 치료반응이 다양할 수 있고, 뼈와 연부조직의 전이는 치료반응이 좋은 부위이다.2) 전이성 신세포암의 항암화악요법은 주로 인터루킨-2와 인터페론-알파를 사용하는데, 부분관해는 5%~20%, 완전관해는 5% 이하로 보고되었다.2) 항암화학요법은 수술 후 재발 시 보조요법으로 고려될 수 있으나,2) 전이부 절제수술 후 시행하는 표적치료의 효과는 아직 검증되지 않았다.21)
본 증례는 신장암 수술 후 16년의 긴 시간이 지난 시점에서 이학적 검사, 영상검사 및 세포검사에서 악성을 시사하는 소견이 없었으므로 수술 전에 신세포암의 악하선 전이를 예상하지 못하였다. 다만 수술 후 조직검사에서 보인 투명세포암종 소견에서 병리의사가 신세포암 전이를 감별진단에 포함하였고, 본 증례의 신장암 병력과 면역화학조직검사를 고려하여 최종적으로 신장암의 악하선 전이로 진단하게 되었다. 따라서 신세포암의 치료 병력이 있을 경우, 10년 이상의 오랜 시간이 지난 뒤에도 신세포암의 전이가 두경부 종물의 감별진단에 포함되어야 할 것으로 생각된다.






