서론
감각 기관은 인간이 외부 세계와 소통하는 수단이다. 후각과 미각은 오감(시각, 청각, 후각, 미각, 촉각)에 속하는 감각 기능으로, 특히나 후각과 미각은 화학적 감각으로 원시적인 위험 인지 기능으로부터 진화를 통해 즐거움을 찾는 삶의 질과도 연관된 중요한 감각이라고 할 수 있다.1) 아울러 문화 및 역사적인 요소와도 관련 있는 감각으로, 문화적인 배경에 따라서 즐기는 후각 및 미각이 서로 달라질 수 있다.2) 또한, 후각과 미각은 인간의 감정과 기억력에도 관여한다.3,4)
후각 및 미각 검사는 이러한 후각, 미각의 장애를 확인하기 위한 기본적인 진단 검사로서의 기능 및 후각 및 미각 장애의 치료 후 변화 확인, 신경퇴행성 질환의 인지 기능 감소의 조기 발견,5,6) 그 외 보험이나 법적인 배상문제를 위한 진단 검사로서의 기능을 가진다. 주관적인 검사 및 객관적인 검사로 크게 나눌 수 있으나, 실질적으로 객관적인 검사의 경우 진료실에 진단 장비가 제대로 구비되지 않는 병원이 많아 임상적으로 시행하기는 쉽지 않다. 또한, 후각원에 의한 자극을 통해 인지되는 후각과는 달리, 미각은 미뢰의 자극 및 후각, 구강 내의 기계적 수용기에 의한 감각, 통각신경섬유에 의한 감각에 의해서도 영향을 받기 때문에 미각 검사는 후각 검사만큼 잘 개발되어 있지 않고, 전세계적으로 아직 표준화된 방법이 없는 실정이다.7)
본 종설에서는 후각 및 미각 장애를 진단하기 위한 검사 중 비교적 우리나라에서 잘 알려진 검사에 대해 소개하고 정리해 보고자 한다.
본론
임상에서 흔히 사용하는 검사로서, 후각의 역치(threshold), 인지(identification), 식별(discrimination) 중 하나가 포함되어야 하며, 표적 인구에 대해 재현이 가능하고 검증된 검사여야 한다.8) 청력 검사와 마찬가지로 후각 자극에 대한 환자의 반응 정도를 통해 검사 결과가 도출되는 검사이기 때문에, 환자의 협조가 필요하며, 환자가 지시 사항을 잘 따를 수 있어야 한다. 반대로, 환자가 후각 검사 방법을 잘 이해하고 있으면 조작이 가능하여 꾀병을 감별하는 데에 한계가 있을 수 있다.
후각 역치 검사는 후각원(odorant)을 인지하는 가장 낮은 농도를 알아보는 검사로서, 50%의 후각원 자극은 인지되나, 50%는 인지되지 않을 수도 있는 농도를 말한다. 후각 역치 검사에는 pyridine, n-butyl alcohol (n-butanol), 장미향이 나는 phenylethyl alcohol이 쓰인다. 빈 병(blank) 혹은 용제가 포함된 경우와 후각원이 들어 있는 경우를 구분할 수 있는 가장 낮은 농도를 측정하는 방법이다. 검사는 가장 저농도부터 검사를 시작하여 용제가 포함된 경우와 후각원이 포함된 경우 중에서 강한 냄새를 선택하게 한다. 후각원이 포함된 경우를 맞히지 못하고 용제가 포함된 경우를 선택하게 되면, 2단계 높은 농도의 후각원이 포함된 경우로 올라가게 된다. 용제가 포함된 경우를 두 번 연속 맞히면 한 단계 낮은 농도의 후각원이 포함된 경우로 내려가며, 7개의 전환점이 생길 때까지 시행하여 그 중 마지막 4개의 전환점의 점수를 평균하여 후각 역치 검사의 점수로 기록한다.
초역치검사는 인지할 수 있는 후각 자극을 확인하는 검사로서, 후각 식별 검사와 후각 인지 검사가 있다. 즉, 후각 식별 검사 및 후각 인지 검사는 후각원의 농도가 초역치 농도(supra threshold level)여야 한다. 후각 역치 검사와는 달리, 초역치 검사는 피검자의 실행 능력 및 의미를 가진 기억력과 관련이 있다.
후각 식별 검사는 3쌍의 후각원을 피검자가 맡아서 2개의 같은 냄새와 다른 한 개의 냄새가 나는 경우를 선택하여 정답을 맞힌 개수를 점수로 기록한다.
후각 인지 검사는 다양한 후각원을 정확하게 가려낼 수 있는지를 확인하는 검사로, 4개의 보기 중 반드시 1개를 선택하게 하여 정답을 맞힌 개수를 점수로 기록한다. 후각의 문화적 경험 및 역사적인 차이가 중시되는 특성으로 인해 각 문화권에 따른 친근한 후각원으로 개발되어 있다.2)
연구에 따르면, 비부비동 질환에 따른 후각 감소의 경우, 특히 후각 역치 점수가 감소하는 경향을 보인 반면, 알츠하이머병의 경우, 후각 식별 검사나 후각 인지 검사와 같은 초역치 검사 점수가 감소하는 경향을 보였다. 즉, 말초성 혹은 전도성의 후각 감소의 경우, 후각 역치 능력이 떨어지며, 중추성 후각 감소의 경우 초역치 검사 능력이 떨어진다고 추정할 수 있다. 이와 같은 현상은 신경퇴행성 질환이 후각 정보 전달 및 처리 구조에 영향을 미쳐 고차원의 후각 능력이 저하되기 때문이다.9,10) 즉, 정신물리학적 후각 검사에서는 후각 역치 및 초역치 검사를 모두 포함하는 것이 종합적인 후각 장애의 진단 검사로서의 가치가 있다.8)
다양한 후각 검사가 존재하지만, 그 중에서 우리나라에서도 비교적 널리 쓰이거나 알려진 검사들을 정리하면 Table 1과 같다.
미국에서 개발된 검사로 신뢰성이 있고 표준화된 검사로 The University of Pennsylvania Smell Identification Test(UPSIT, Sensonics, Haddon Heights, NJ, USA)11)가 있으며, 그 중 각 문화권에 친숙한 대표 항목을 선택하여 보완한 Cross-Cultural Smell Identification Test(CC-SIT)12)가 대표적인 후각 인지 검사이다. UPSIT은 40개의 미세캡슐에 담긴 냄새를 펜으로 긁어서(scratch and sniff) 4가지 중 하나의 냄새를 알아 맞히는 방법이다. CC-SIT는 UPSIT을 보완하여 여러 민족에게 익숙한 냄새 12가지를 사용한 방법이다. 특별히 검사자의 감시가 필요 없다는 장점이 있는 반면, 검사 비용이 비교적 많이 드는 편이다.
독일에서 개발된 Sniffin’ Sticks test(Burghart Messtechnik GmbH, Wedel, Germany)13,14)는 후각 역치, 식별, 인지 검사를 모두 포함하여 합산하여 나타내는 검사로서, UPSIT과 마찬가지로 재현성이 좋으며, 검증된 방법이다. 펜 형태로 후각원을 사용하도록 하여 재사용이 가능한 대신, 피검자에 대한 검사자의 감시가 필요하다.
Korean Version of Sniffin’ Sticks(KVSS, Burghart Messtechnik GmbH, Wedel, Germany) 검사15)는 Sniffin’ Sticks test 중 인지 검사의 냄새를 한국인에 친숙한 것으로 변경한 것이다. KVSS 검사는 선별검사용인 KVSS-I 및 정식 검사인 KVSS-II가 있다. KVSS-II의 경우, 우리나라의 인구들을 대상으로 검증되었으며, 각각 16개의 후각 역치, 식별, 인지 점수를 합산하여 48점 만점에서 일반적으로 15점 이하의 경우 후각의 완전 소실, 15점 초과 30점 미만의 경우 후각 감퇴, 30점 이상의 경우 정상 후각으로 진단한다. 이는 우리나라에서 보험이나 법적인 배상문제를 위한 평가 검사로 인정받고 있다.
최근에 한국에서 개발된 YSK Olfactory Function test(YOF test, Kimex Co., Suwon, Korea)16)는 마찬가지로 각각 12개의 후각 역치, 식별, 인지 검사를 합산하여 나타내는 검사이며, 12개의 후각 인지 검사 후각원 중 8개는 주요 작용기를 가진 후각원이며, 4개는 한국인에게 친근한 후각원으로 구성되어 있다. 36점 만점에서 15점 이하의 경우 후각의 완전 소실, 15점 초과 21점 이하의 경우 후각 감퇴, 21점 초과의 경우 정상 후각으로 간주한다. 기존의 KVSS-II 검사와의 상관 관계를 확인 시, 동등한 정도의 검사 능력치를 확인할 수 있었다.16) 아울러 후각 역치 검사에서 흡인 독성의 가능성이 있는 n-butyl alcohol (n-butanol)17,18) 대신 phenylethyl alcohol을 사용하여 물질안전보건자료(Material safety data sheet)를 갖추고 있다. 2020년 7월에는 산업재해보상보험법 후각 장해 평가를 위한 검사 인정기준에서 KVSS-II의 대체 검사로 인정받아 향후 국내에서 그 쓰임이 증가할 것으로 예상된다.
그 외, 미국에서 개발된 Conneticut Chemosensory Clinical Research Center Test(CC-CRC)19)은 부탄올을 이용한 역치 검사와 10가지 냄새를 이용한 인지 검사의 합산 점수를 이용하여 후각을 측정하는 검사이다. 이와 비슷하게 일본에서는 T&T olfactometer(Daiichi Yakuhin Sangyo, Tokyo, Japan)20)를 개발하여 사용하는데, 일본인에게 익숙한 5가지 후각원(β-phenylethyl alcohol, methyl cyclopentenolone, isovaleric acid, γ-undecalac-tone, and skatole)을 7~8개의 농도로 나누어 후각 인지 역치(detection threshold)와 감지 역치(recognition threshold)를 측정하여 후각 장애의 정도를 측정한다. 그 외 정맥 내 Alinamine(thiamine propyl disulfide)21,22) 주사를 이용한 검사도 있는데, 정맥 내 주사를 한 후에 느껴지는 마늘 냄새를 처음으로 느끼는 잠복 시간(latent time)과 계속해서 느끼는 지속 시간(duration time)을 측정하여 후각 장애의 정도를 파악한다. 정상인에서 잠복 시간은 대략 8초이며, 지속 시간은 대략 70초이다. Alinamine 검사에서 반응이 없을 경우, 후각 장애의 나쁜 예후를 시사한다.
객관적 후각 검사는 후각 자극 이후의 신체적 변화를 측정하는 것으로, 검사 시 적절한 후각원 농도의 전달이 조절될 수 있어야 한다.
전기후각검사(Electroolfactogram; EOG)23)는 냄새로 코를 자극한 후에 직접 후각 상피에 위치한 미세전극에서 나타나는 전위를 측정하는 검사이다. 다만, 검사 방법의 침습성으로 인해 임상적으로 이용되는 경우는 거의 없으며, 연구 목적으로 사용될 수 있다.
후각유발전위검사(olfactory evoked potential; OEP), OERP (olfactory event-related potential)는 냄새로 자극한 후에 나타나는 뇌파(Electroencephalogaphy, EEG) 상의 변화를 측정하는 검사이다.24) 전위의 진폭(amplitude)과 잠복기(latency) 변화에 따라서 후각 인지 경로의 이상 부위 또는 기류의 폐쇄 여부를 반영한다. 전기후각검사보다는 덜 침습적으로 정신물리학적 후각 검사가 불가한 경우의 법적인 배상 문제를 확인하기 위해 사용할 수 있다.
그 외에 후각 자극 후에 나타난 뇌 혈류액 산소 농도 변화의 신호를 사용하여 뇌의 활동성을 지도화할 수 있는 양전자방출단층촬영(positron emitting tomography, PET)과 기능성 자기공명영상(functional MRI, fMRI)이 연구용 검사로 주목받고 있는데, fMRI가 PET과는 달리 방사능 위험이 없어 최근 연구용 검사로 많이 이용되고 있다.25-27)
미각은 검사 부위에 따라 전구강 미각 검사(whole-mouth taste test)와 국소미각 검사(spatial taste test)로 나눌 수도 있는데, 화학 미각 검사에서는 미각 시험 용액을 입안 전체에 머금었다가 삼키거나 뱉으면서 구강 전체의 미각 기능을 검사하는 전구강 미각 검사와 미각원을 연구개, 혀뿌리, 혀 전단의 각각 다른 부위에 묻혀 각 부위의 미각 기능을 검사하는 국소 미각 검사가 모두 가능하며, 각각의 맛을 구별하는 정성적 검사와 역치값을 측정하는 정량적 검사가 모두 가능하기 때문에 임상에서 가장 보편적으로 사용되고 있다.
화학 미각 검사는 미각 용액을 이용하여 피검자의 반응을 확인하는 검사법이다. 검사의 정확도를 높이기 위해 피검자는 검사 한 시간 전부터 물을 제외한 음료 및 식사, 흡연, 양치질을 금해야 한다. 단맛은 자당(sucrose), 짠맛은 소금(sodium chloride), 신맛은 구연산(citric acid), 쓴맛은 카페인(caffeine) 혹은 키니네(quinine hydrochloride) 등으로 평가를 하게 된다. 검사 전후에는 탈이온화된 물로 입안을 깨끗이 헹궈서 다른 맛을 평가할 때 영향을 주지 않도록 한다. 각각의 용액에 대해 여러 단계의 희석 용액을 만들되, 각 단계별 희석 배수는 2배로 한다. 한 가지 맛에서 다른 맛으로 넘어갈 때에는 증류수로 입을 헹구게 한다.
후각 검사와 마찬가지로, 미각 검사에도 역치 검사와 초역치검사(supra threshold test)가 있다. 다만, 역치 검사는 감지 역치 검사(detection threshold)와 인지 역치 검사(recognition threshold)로 나뉘는데, 감지 역치 검사는 어떤 미각 물질을 증류수와 구분할 수 있는 최저 농도를 말하며, 인지 역치 검사는 어떤 미각 물질이 나타내는 맛을 느낄 수 있는 최저 농도를 뜻한다. 초역치 검사는 어떤 미각 물질이 인지 역치 이상의 농도에서 나타내는 맛의 강도를 측정하는 검사이다. 일상 생활에서 느끼는 미각 장애는 희석된 역치 농도 수준의 자극에 의한 것이라기보다는 초역치 농도 수준의 자극에 의한 것이기 때문에 초역치 검사와 관련성이 높다.
화학 미각 검사 시, 구강 구역에 미각원을 전달하는 방법에 따라 미각 용액을 적신 면봉을 사용하는 방법, 미각 용액을 적신 여과지(filter paper disk)를 사용하는 방법,28) 마른 미각원(dried tastant)을 이용한 맛 스트립(taste strip)을 사용하는 방법이 있다.29,30) 맛 스트립 방법의 경우, 다른 방법과 비교 시, 보관 기간이 긴 장점이 있다.
최근 다섯 번째 기본 미각으로 알려진 monosodium glutamate로 평가하는 감칠맛(umami)을 포함한 미각 검사가 한국인을 대상으로 개발되었다(YSK Gustatory Function Test).31) 상기 검사는 5가지 미각원(단맛, 짠맛, 신맛, 쓴맛, 감칠맛)에 대해 각각 6개의 농도로 이루어진 용액으로 구성되어 전구강 검사로 진행하고 있으며, 미각 감지 및 인지 역치를 합산한 미각 점수를 계산한다. 한국인을 대상으로 검증된 검사로서 추후 그 유용성이 커질 것으로 기대된다.
그 외에 후각 장애 진단에 이용되는 alinamine 검사와 마찬가지로 decholin이나 saccharin 검사가 미각 검사에 이용되기도 한다. 정맥 주사 후 decholin의 경우, 쓴맛, saccharin의 경우 단맛을 느끼기까지의 잠복 시간과 지속 시간을 측정할 수 있으며, 미각 장애 환자에서는 잠복 시간이 길어지고, 맛을 느끼는 지속 시간이 정상인에 비해 짧아진다.32)
객관적 미각 검사로는 전기미각검사법(electrogustometry) 및 미각유발전위검사(gustatory evoked potentials)가 있다. 다만, 임상에서의 쓰임새는 많지는 않은데, 그 이유는 진료실이나 검사실에 마땅한 검사 방법이나 진단 장비가 구비되어 있지 않아서인 경우가 많다.7)
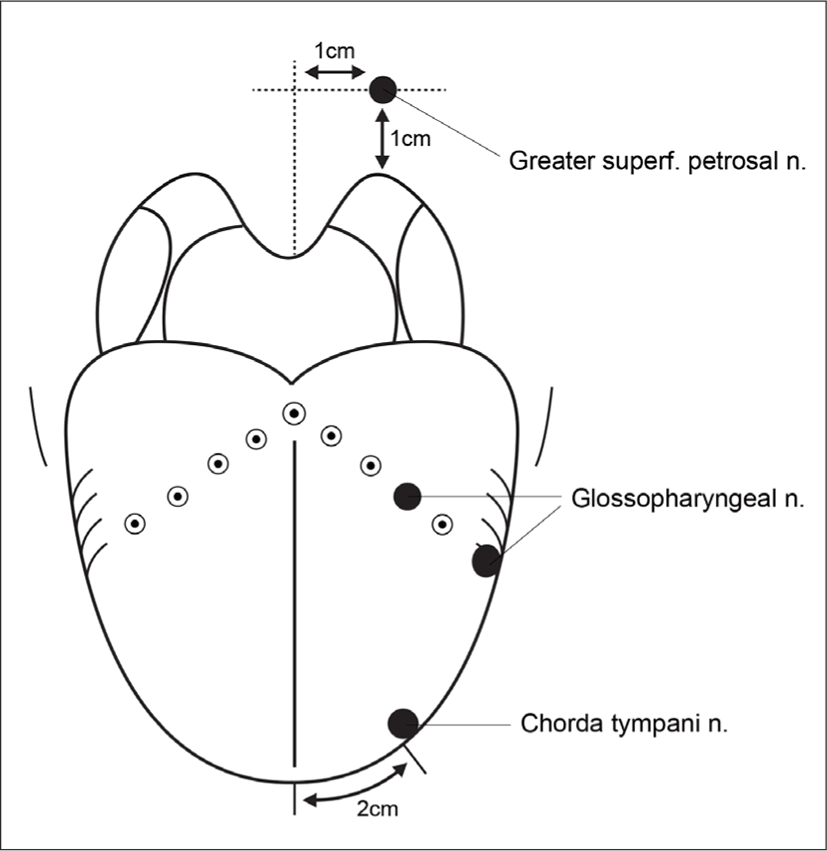
전기미각검사법의 경우, 화학 물질 대신 혀의 미뢰 신경 분포 부위에 양극 전류를 주면 시고 금속성의 맛을 느끼고, 음극 전류를 주면 쓰고 단맛을 느끼는 것을 이용한 검사이다.33) 전기 미각 측정기(Electrogustometer, Model TR-06, Nagashima medical Instrument Co., Japan)를 사용하여 연구개, 혀뿌리, 혀 전단의 양측 대칭되는 여섯 부위에서 측정한다(Fig. 1). 대천추체신경(greater superficial petrosal nerve), 설인신경(glossopharyngeal nerve), 고삭신경(chorda tympani nerve) 등의 신경이 관장하는 미뢰에 대한 양극 전류의 역치 표준치가 알려져 있어서, 손상된 신경을 확인하는 데에 도움이 된다. 아울러 재현성이 뛰어나고, 정량적 측정이 가능하며, 자극 범위를 정확하게 조절할 수 있고, 검사 시간이 짧으며, 가벼운 미각 장애도 검출할 수 있다는 장점이 있다.33) 하지만, 미각의 종류에 대한 구분과 미각 강도의 측정은 불분명하다는 단점이 있다.34) 특히나 양극 전류에 민감한 신맛과 짠맛을 감지하는 미각 세포로부터 낮은 전류에서도 강한 반응을 유도할 수 있는 반면, 음극 전류를 이용한 단맛과 쓴맛의 평가에는 반응 정도가 작아 적절하지 않을 수 있다.35) 객관적 후각 기능 검사 중 전기후각검사와 마찬가지로, 검사 방법의 침습성으로 인해 임상적으로 실제로 이용되는 경우는 많지는 않으며, 연구 목적으로 사용될 수 있겠다. 미각유발전위검사의 경우, 미각 용액을 혀 점막에 접촉시켜 자극한 후에 나타나는 뇌파(electroencephalography, EEG) 상의 변화를 측정하는 검사이다.36) 두정부(vertex)에서 가장 뚜렷하게 기록되며, 농도가 높아질수록 진폭은 증가하고 잠복기는 감소하는 경향이 있다. 후각유발전위검사와 마찬가지로 전기미각검사보다는 덜 침습적으로 화학 미각 검사가 불가한 경우의 법적인 배상 문제를 확인하기 위해 사용할 수 있다.
결론
후각 및 미각 검사는 위험 감지 및 일상 생활에서의 삶의 질과 관련된 후각, 미각의 장애를 확인하기 위한 진단 검사이며, 신경 퇴행성 질환의 조기 진단, 법적인 배상 문제와 연관된 검사이기도 하다. 자극에 대한 환자의 반응을 평가하는 주관적인 검사와 객관적인 신체의 반응을 평가하는 객관적인 검사가 있다. 주관적인 검사의 경우, 실제로 임상적으로 후각 및 미각 검사에 많이 활용되고 있다. 하지만, 후각 검사보다 미각 검사에 대한 임상 연구들은 상대적으로 부족한 상황이며, 후각 및 미각 검사와 관련하여 한국인을 대상으로 표준화된 더 많은 연구가 앞으로도 필요할 것으로 보인다. 객관적인 검사의 경우, 침습성 및 검사의 복잡성으로 인해 실질적으로 임상에서 시행하고 있는 병원은 많지 않고, 연구용으로 진행되는 경우가 많다. 하지만, 이러한 객관적인 검사 또한 주관적인 검사가 불가하거나 꾀병이 의심되는 경우, 후각 및 미각 장애의 법적인 배상 문제를 확인하기 위해서는 반드시 고려해야 할 것이다.






