서 론
호흡기 알레르기 염증반응은 대식세포, 림프구, 호산 구, IgE 등이 관여하며, 조직내 염증세포의 침윤과 염증 성 매개물질의 증가를 특징으로 한다.1) 집먼지 진드기는 호흡기 알레르기 질환을 유발하는 중요한 원인 항원으로 기관지 천식, 알레르기비염, 아토피 피부염 등의 발병과 관련이 있다.2) 집먼지 진드기는 17종 이상의 항원들이 밝 혀져 있으며, 그 중 유럽형 집먼지 진드기(Dermatophagoides pteronyssinus, DP)와 미국형 집먼지 진드기(Dermatophagoides farina, DF)가 대표적인 항원이다. 집먼 지 진드기는 다양한 단백질 분해효소를 가지고 있으며 호흡상피세포의 세포간 폐쇄막과 같은 물리적 장벽에 장애를 초래함과 동시에 상피세포 수용체를 통해 활성 화를 유도하고 다양한 화학매개물질의 생성에 관여한 다.3,4) 호흡기 점막은 공기중에 존재하는 다양한 병원성 혹은 항원성 물질과 직접 접촉하게 되는 첫번째 내재면 역계(innate immune system)이다. 하지만 호흡상피세포 가 병적인 환경에 노출되게 되면 구조적인 변화가 초래 되고, 점액 분비 이상으로 인한 점액섬모운동 장애나 항 균펩타이드 생성 장애 등으로 내재면역계에 이상이 초 래 될 뿐 아니라 상피세포에서 만들어진 다양한 염증성 매개물질은 염증세포의 이주와 활성화를 유도하고 T세 포나 B세포 등의 면역세포와 상호작용을 통한 적응면역 계(adaptive immune system)를 조절하게 된다.5-7)
나무정유는 수목 자신을 미생물, 해충 등의 공격으로 부터 보호하기 위해 만들어지는 휘발성 방향 물질로 나 무의 종류에 따라 그 성분과 특성에 차이를 보인다. 나무 정유는 항균작용, 소취작용, 진정작용, 스트레스 해소 등 다양한 기능을 가지고 있어 일상 생활에 광범위하게 사 용되고 있다.8,9) 그 중 편백나무는 아열대성 식물로 국내 에서는 남해안 지역에 군락지가 분포해 있으며, 타 나무 에 비해 많은 양의 나무정유를 함유하고 있고 phenolics, terpenoid, alkaloid, phenylpropane, acetogenin 등의 화 합물로 구성되어 항염증 뿐 아니라 항세균, 항진균 등의 특성을 가지고 있다.10,11)
호흡상피세포에서 만들어지는 interleukin-6(IL-6), IL-8, granulocyte-macrophage colony stimulating factor(GM-CSF)는 다양한 면역세포의 이주와 활성화 에 관여하며, 집먼지 진드기는 상피세포의 protease-activated receptor 2(PAR2)와의 상호작용을 통해 염증성 매개물질을 만들게 된다.3,12) 본 연구는 국내에서 생산된 편백정유가 집먼지 진드기에 의한 기관지 상피세포의 화 학매개물질 생성에 미치는 영향과 그 기전을 확인해 보 고자 하였다.
대상 및 방법
편백정유는 마산지역 군락지에서 편배나무의 잔가지와 잎을 고온 스팀 처리 후 응축시킨 정유액을 큐웰사(Seoul, Korea)에서 제공받아 사용하였다. 계절에 따른 나무 정 유의 특성 차이가 있을 수 있어 잔가지와 잎은 1년동안 채취하여 사용하였으며, 사용된 편백정유는 생산 후 1년 간 보관하여 안정화가 확보된 것을 사용하였다.
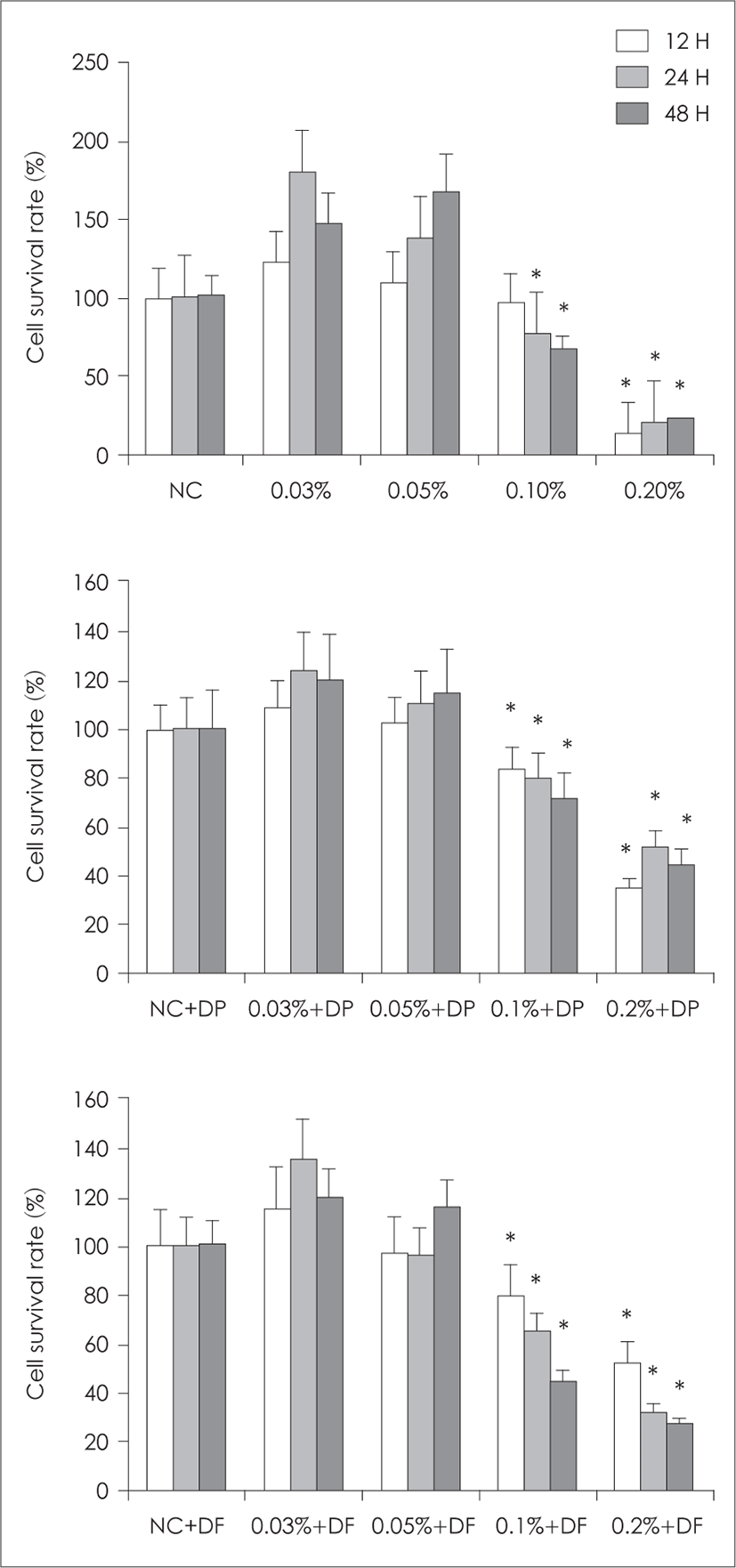
기관지 상피세포는 American Type Culture Collection (Rockville, MD, USA)에서 구매한 인체 기관지 상피세 포주인 BEAS-2B를 사용하였다. 편백정유의 상피세포 에 대한 세포독성을 확인하기 위하여 0.03, 0.05, 0.1, 0.2% 의 편백정유를 BEAS-2B 세포와 함께 12, 24, 48시간 배 양하여 세포독성을 분석하였다. 편백정유와 집먼지 진 드기를 함께 처리한 경우 세포독성의 상승효과를 확인하 기 위하여 다양한 농도의 편백정유와 50 μg/mL의 DP, DF(Greer Lab, Lenoir, NC, USA)와 함께 48시간 처리 하였으며, 세포독성은 CellTiter-96® aqueous cell proliferation assay kit(Promega, Madison, WI, USA)를 사 용하여 확인하였다. 배양된 상피세포를 tetrazolium 합 성물과 phenazine methosulfate를 섞어 37°C, 5% CO2에 서 4시간 처리 후 490 nm의 microplate reader (Modecular Devices, Sunnyvale, CA, USA)를 사용하여 흡광도 를 측정하였다.
BEAS-2B 세포는 열처리된 10% fetal bovine serum (Invitrogen, Carlsbad, CA, USA), 100 U/mL의 penicillin과 100 μg/mL의 streptomycin을 함유하는 DMEM/ F12(GIBCO, Grand Island, NY, USA) 배양액으로 37℃ 5% CO2에서 배양하였다. 상피세포가 80% 이상의 융합 성단층이 형성되면 25 μg/mL과 50 μg/mL의 DP와 DF 로 48시간 처리한 후 상등액을 얻어 -70℃에 보관하였다. 양성 대조군으로는 10 ng/mL의 tumor necrosis factor-α(TNF-α)를 사용하였다. 집먼지 진드기에 의한 상피세 포의 활성화 여부를 확인하기 위하여 상등액에 포함된 화학매개물질인 IL-6와 IL-8을 효소면역분석법(R&D system, Minneapolis, MN, USA)을 이용하여 측정하였 으며, 민감도는 5 pg/mL이었다.
편백정유에 의한 기관지 상피세포의 활성화 억제를 확 인하기 위하여 집먼지 진드기로 상피세포를 처리하기 1시 간 전 0.02%, 0.03%, 0.04%, 0.05%의 편백정유로 처리하 여 배양 후 IL-6, IL-8의 생성 억제 여부를 확인하였다.
BEAS-2B세포를 다양한 조건으로 한시간 처리 후 상 피세포 전사인자 발현을 확인하기 위하여 western blot 분석을 시행하였다. Trypsin-EDTA로 상피세포를 모아 NE-PER nuclear and cytoplasmic extraction reagents (Pierce Chemical, Rockfored, IL, USA)를 사용하여 세 포 핵 추출물을 분리하였으며, 단백질량은 BCA protein assay reagent kit(Pierce Chemical)를 사용하여 측정하 였다. 정량한 sample을 같은 양으로 NuPAGE 4~12% Bis-Tris gel(Invitrogen, Carlsbad, CA, USA)에 전기영 동 후 Xcell Surelock(Invitrogen)을 이용하여 nitrocellulose membrane(Bio-Rad Lab., Hercules, CA, USA) 에 1시간 transfer하였으며 membrane blocking solution (Invitrogen)에서 1시간동안 incubation하였다. 준비 된 membrane에 Nuclear factor kappa B(NF-κB), 인산 화-NF-κB(p-NF-κB), c-Jun, p-c-Jun, p38, p-p38, JNK, p-JNK, ERK, p-ERK(Santa Cruz Biotechnology, Santa Cruz, CA, USA)로 처리 하였으며, 다음날 NF-κB는 HRP-conjugated된 goat anti-rabbit antibody (Santa Cruz)를 사용하였고, p-NF-κB, c-jun, p-c-jun, p38, p-p38, JNK, p-JNK, ERK, p-ERK 은mouse IgG kappa binding antibody(Santa Cruz)와 함께 반응시킨 후 SuperSignal West Pico Chemiluminescent Substrate (Pierce Chemical)를 이용하여 Gel Doc XR+(Bio-Rad Lab.)으로 protein 발현량을 확인하였으며, 편백정유로 처리하지 않은 군과의 상대적인 발현량 차이를 확인하 였다.
결 과
다양한 농도의 편백정유와 BEAS-2B 세포를 12, 24, 48시간 배양 후 상피세포의 분화를 측정하였을 때 편백 정유 0.1%의 농도 이상에서 24시간 이상 처리한 경우 상 피세포 분화도가 유의하게 감소하였다(24시간에 77%, 48시간 66%). 편백정유와 50 μg/mL의 집먼지 진드기를 포함한 배양액으로 상피세포를 처리했을 때에도 편백 정유 0.1% 이상에서 상피세포 분화도가 유의하게 감소 되었다(Fig. 1).
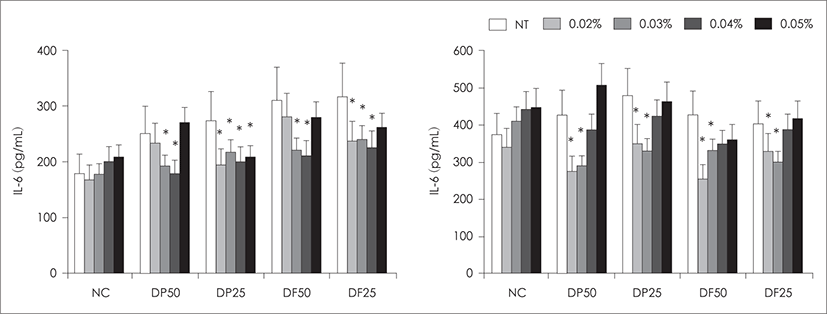
BEAS-2B를 집먼지 진드기로 활성화를 유도하기 한 시간 전 다양한 농도의 편백정유로 처리하여 상피세포의 IL-6와 IL-8 생성에 미치는 영향을 확인하였다. DP와 상피세포를 함께 배양한 경우 음성 대조군(IL-6 ; 179.5 ±47.6 pg/mL, IL-8 ; 375.4±136.3 pg/mL)에 비해 IL-6는 152%, IL-8은 133% 생성이 증가하였고, DF와 함께 배양한 경우에도 IL-6의 경우 177%, IL-8은 114% 생성 이 증가하였다. 편백정유로 전처리 한 경우 DP와 DF에 의한 IL-6의 생성이 억제되었으며, 특히 편백정유 0.03% (20~29%)와 0.04%(27~32%)를 사용한 경우 유의하게 IL-6의 생성을 억제하였다. DP와 DF에 의한 IL-8의 생 성은 편백정유 0.02%(29~45%)와 0.03%(23~42%)로 전 처리한 경우에 유의하게 감소하였다(Fig. 2). 10 ng/mL 의 TNF-α로 처리한 경우 IL-6(3816.2±1324.2 pg/mL) 와 IL-8(7265.2±1754.6 pg/mL)의 생성이 강력하게 증 가하였으나 편백정유로 전처리한 경우 TNF-α에 의한 IL-6와 IL-8의 생성 억제효과는 없었다.
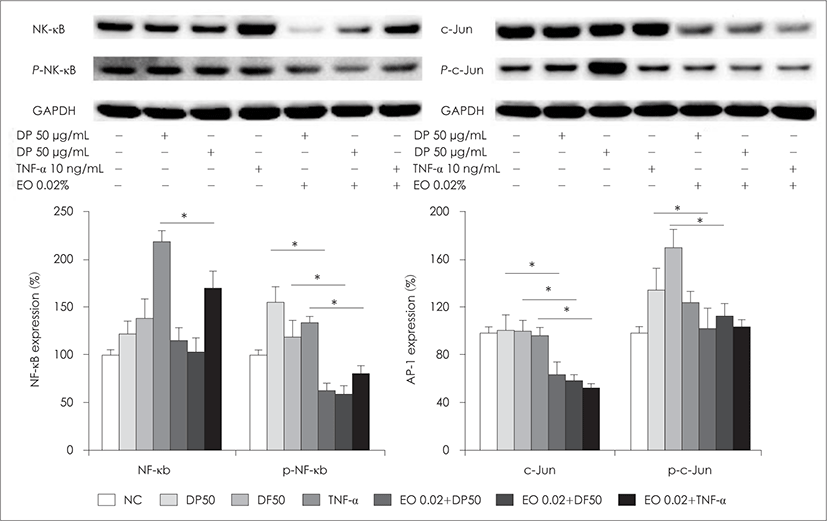
50 μg/mL의 집먼지 진드기와 0.02% 편백정유에 의한 BEAS-2B 세포의 전사인자 발현을 확인하기 위하여 상 피세포를 1시간 처리 후 western blot을 이용하는 NF-κB, activator protein 1(AP-1 ; c-Jun), mitogen-activated protein kinase(MAPK ; ERK, JNK, p38)의 발현 을 확인하였다. 호흡상피세포의 경우 DP와 DF에 의해 인 산화된 NF-κB의 발현이 유의하게 증가하였으며, 0.02% 편백정유로 전처리한 경우 유의하게 NF-κB의 발현이 억제되었다. AP-1의 경우는 인산화 유무에 관계없이 DP 와 DF에 의해 전사인자의 발현이 증가하였으며, 편백정 유의 전처리에 의해 유의하게 AP-1의 발현이 유의하게 억제되었다(Fig. 3). 하지만 MAPK의 경우는 비인산화 p38의 경우 집먼지 진드기에 의해 발현이 증가하였으나 그 외의 전사인자의 발현에는 변화가 없었으며, 편백정 유로 전처리한 경우에도 MAPK의 발현에는 영향을 미 치지 못하였다.
고 찰
약용식물요법(phytotherapy)는 천연 추출물을 사용 하여 인체에 부작용 없이 다양한 효과와 건강 증진을 위 해 사용되는 대체의학이다.13) 편백정유가 함유하고 있는 sabinene, limonene, a-trepineol 등의 휘발성 성분은 향 기치료, 향료, 방향제 등에 이용되고 있다. 국내에서 생 산된 편백정유는 그람 양성균과 음성균, 효모형 곰팡이 와 사상형 곰팡이에 대해 향균력을 가지고 있으며, 말초 혈액 단핵구의 염증성 매개물질 생성을 억제하고 prostgladin E2, tumor necrosis factor-α, cyclooxygenase-2 등의 생성 억제 통해 항염증, 항산화 효과를 가진다.14-17) 본 연구의 경우 편백정유 0.1% 이상의 농도에서 배양 시 간에 관계없이 기관지 상피세포에 대한 세포독성을 보 여 추가적인 연구는 그 이하의 농도를 이용하여 진행하 였다.
집먼지 진드기는 호흡기 알레르기질환을 유발하는 대 표적인 항원물질로 호흡상피세포의 수용체를 통해 다양 한 염증성 매개물질의 생성을 유도한다. 본 연구에서 50 μg/mL의 집먼지 진드기를 사용하였는데, 이는 기존의 연구에서 DP와 DF 모두 50 μg/mL에서 상피세포의 화 합매개물질 생성 유도가 가장 강하게 나타났으며, 그 이 상의 농도에서는 상피세포의 형태학적 이상이 확인되었 었다.18) 집먼지 진드기의 단백질 분해효소는 호흡 상피 세포의 물리적 방어구조의 손상을 유도하고, 점막 투과 성의 변화를 초래 할뿐 아니라 호흡기 점액 성분과 특성 의 변화를 초래하여 국소 염증반응을 유지 악화시키게 된다.3,4) 집먼지 진드기에 의한 호흡상피세포의 활성화는 집먼지 진드기의 단백질 분해효소와 상피세포의 PARs 등의 상호작용이 관여하는 것으로 알려져 있다.3,12) 편백 정유로 상피세포를 전처리 한 경우 집먼지 진드기에 의한 BEAS-2B 세포의 IL-6 생성은 편백정유 0.03%와 0.04% 에서, IL-8은 편백정유 0.02%와 0.03%에서 유의하게 생 성이 억제되었으며, IL-6는 편백정유 0.05%, IL-8의 경 우 편백정유 0.04%와 0.05%의 고농도에서 도리어 생성 이 증가하였다. 이는 편백정유가 저농도에서는 화학매개 물질의 생성을 감소시키는 면역억제 효과를 보이나 고 농도에서는 도리어 면역반응을 촉진시키는 경향을 보 여, 편백정유의 경우 염증반응을 유발하는 조건이나 환 경에 따라 면역학적 기전이 다르게 나타날 수 있음을 추 측할 수 있다.
NF-κB와 AP-1은 인체 염증반응 뿐 아니라 배아 형 성, 림프 분화, 종양 발달과 세포 사멸에 관여하는 중요 한 전사인자이다.19) NF-κB와 AP-1은 서로 다른 조절 기전을 가지고 있지만 NF-κB와 AP-1의 활성화에 관 여하는 많은 공통된 유전자들을 가지고 있다. 이는 이들 두 전사인자가 인체의 항상성 유지를 유해 서로 협력하 고 상호 보완하는 기능을 가지고 있는 것으로 생각된 다.19) 집먼지 진드기에 의한 호흡기 상피세포의 화학매 개물질 생성에 NF-κB와 AP-1이 관여하는 것으로 알려 져 있으며,20) 저자의 경우도 집먼지 진드기에 의해 BEAS-2B 세포의 NF-κB와 AP-1 전사인자의 발현과 활 성화가 증가하는 것을 확인할 수 있었으나 MAPK의 발 현에는 영향을 미치지 않았다. 하지만 집먼지 진드기 항 원 중 하나인 Der P5의 경우 호흡기 상피세포의 염증성 매개물질의 생성에 TLR2, NF-κB와 MAPK 신호전달 경로가 관여하여, 집먼지 진드기의 다양한 항원에 따라 서로 다른 기전을 통해 상피세포가 활성화 될 수 있음을 알 수 있었다.21) 집먼지 진드기에 의한 기관지 상피세포 의 NF-κB와 AP-1 발현과 활성화는 편백정유에 의해 의미있게 억제되어 편백정유가 호흡기 알레르기 염증반 응을 억제할 수 있음을 확인할 수 있었다.
이상의 결과들을 종합해 보면, 편백정유는 집먼지 진드 기에 의한 기관지 상피세포의 활성화, 특히 IL-6와 IL-8의 생성을 유의하게 감소시켰으며, 이 과정은 NF-κB 와 AP-1 전사인자 발현 억제를 통해 이루어 짐을 알 수 있었다. 이상의 결과를 바탕으로 편백정유를 호흡기 알 레르기 염증반응 억제제로의 개발 가능성을 확인할 수 있었다. 하지만 편백정유의 경우 40여 종의 화학물질로 구성되어 있고 이들 성분 중 어떤 물질이 호흡기 염증반 응 혹은 알레르기 염증반응 억제에 관여하는지는 알 수 가 없어 향후 편백정유의 다양한 성분들에 대한 면역학 적 특성을 규명하는 추가적인 연구가 필요할 것이다.






