서론
폐쇄성수면무호흡증(obstructive sleep apnea, OSA)은 반복적인 상기도 허탈로 인해 저환기, 간헐적 저산소증, 수면 분절을 유발하는 만성 질환으로, 심혈관계, 대사계 합병증 및 삶의 질 저하와 밀접하게 연관되어 있다. 양압기(positive airway pressure) 치료는 중등도 이상의 OSA에 대한 표준 치료로 자리 잡았으나, 상당수 환자에서 장기적인 순응도 문제가 지속되며 대체 치료에 대한 요구가 증가하고 있다. 이러한 상황에서 설하신경자극술(hypoglossal nerve stimulation, HGNS)은 수면 중 상기도 개방을 유도하는 생리학적 접근법으로 주목받고 있으며, 해부학적 및 기능적 맞춤치료를 가능하게 하는 새로운 치료 플랫폼으로 자리매김하고 있다.1) 본 종설에서는 최근 주로 사용되고 있는 설하신경자극술 관련된 장치의 구조와 자극 기전, 수술 술기, 적응증 및 금기, 주요 임상 연구 결과를 종합적으로 고찰하고, 최신 근거를 기반으로 향후 발전 가능성을 논의하고자 한다.
본론
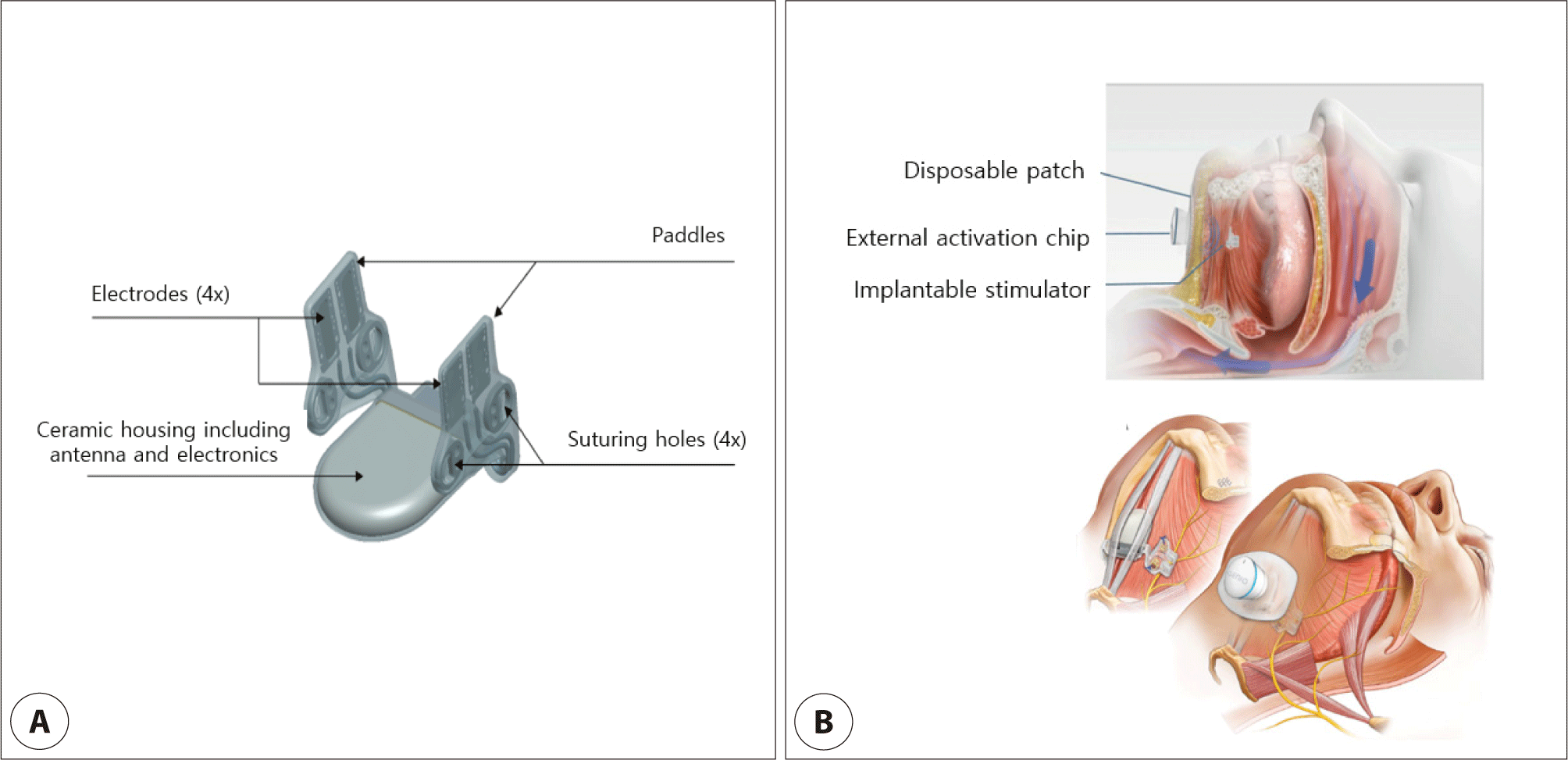
상기도 폐쇄에 의한 폐쇄성수면무호흡증의 치료를 위해 현재 임상현장에서 주로 사용되고 있는 설하신경(hypoglossal nerve)을 자극하는 대표적인 장비는 Inspire Medical Systems사(Golden Valley, MN, USA)의 Inspire® upper airway stimulation system과 Nyxoah사(Nyxoah SA, Mont-Saint-Guibert, Belgium)의 Genio® System이 있다.
현재 가장 많이 사용되고 있는 Inspire® upper airway stimulation system(Inspire Medical Systems)은 다음과 같은 세 가지 구성요소로 이루어져 있다(Fig. 1).2) 1) 체내 삽입형 펄스 발생기(implantable pulse generator, IPG)는 우측 쇄골아래 흉부 피하에 이식되며 IPG 내부에는 설하신경자극술의 치료설정을 저장 및 제어하는 전자장치(electronics)와 배터리(battery)가 들어있다. 자극리드(stimulation lead)와 호흡감지리드(respiratory sensing lead)의 커넥터와 호환되는 2개의 low-profile connector ports는 이들 리드와의 연결을 통해 호흡을 감지하고 설하신경에 대한 자극 신호를 전달하는 핵심 역할을 한다(Fig. 1). 2) 호흡감지리드는 환자의 호흡노력을 감지해서 호흡신호를 IPG에 전달하는 역할을 한다. 리드 한쪽 끝의 sensor tip이 흉부의 제5늑간에서 외늑간근과 내늑간근 사이에 위치하여 호흡시 발생하는 기계적인 압력변화를 압력감지막(sensor membrane)을 통해 전기신호로 변화시키고 이 정보가 다른 한쪽 끝의 커넥터 핀을 통해 IPG에 전달된다(Fig. 1). 3) 자극리드는 한쪽 끝은 커넥터 핀으로 IPG와 이어지고 다른 한쪽 끝에는 커프의 안쪽표면에 있는 유연하고 크기가 조절되는 전극을 통해 설하신경의 내분지(medial branch)와 연결된다(Fig. 1).

Inspire® upper airway stimulation system은 환자가 잠을 자는 동안 호흡감지리드가 흡기 시점의 압력변화를 감지하여 IPG에 신호를 보내면 IPG가 이와 동기화된 전기자극을 생성하여 자극리드를 통해 설하신경 내분지의 지배를 받는 혀의 전진근을 자극하여 기도가 열려지게 한다. 설정된 치료 세팅은 IPG에 저장되며, 의사가 외부 프로그램을 사용하여 설정 및 조정할 수 있다. 환자는 취침 전에 Inspire 수면 리모컨을 이용하여 Inspire® upper airway stimulation system을 활성화함으로써 치료를 시작하고, 기상 후 동일한 리모컨을 사용하여 시스템을 비활성화하여 치료를 종료할 수 있다. 또한 Inspire 수면 리모컨은 치료 중 일시 중지 기능을 제공하며, 담당 의사가 설정한 허용 범위 내에서 자극 진폭도 조절할 수 있도록 설계되어 있다.
기존의 inspire 시스템을 업그레이드하여 2024년 8월 미국 FDA 인가를 받은 Inspire V 시스템은 기존 Inspire 기기에 비해 리드 구조 단순화(호흡감지리드 제거), IPG 및 외부 인터페이스의 무선화 · 사용성 향상, 삽입 위치의 유연성 증가 등 여러 기술적 개선이 이루어졌다.3) 이러한 변화는 수술 시간 및 합병증 감소에 기여할 수 있으며, 최근 적응증 확대와 함께 다양한 환자군에서 적용 가능성이 높아지고 있다.
Genio® system(Nyxoah SA)은 중등도에서 중증에 이르는 폐쇄성수면무호흡증 환자를 대상으로 개발된 설하신경 자극 치료 기기로, 기존 상기도신경자극 장치인 Inspire® upper airway stimulation system과 비교하여 구조적 · 기술적으로 차이가 있다.4) Genio® system은 턱 아래(submental) 부위에 단일 자극 모듈을 삽입하는 리드리스(lead-less) 구조를 채택하고 있으며, 체내에 배터리를 내장하지 않고 외부 웨어러블 활성화 칩(activation chip)을 통해 매일 수면 시 구동되는 외부 전원 · 무선 활성화 방식을 사용한다. 이로 인해 수술 시 별도의 자극리드나 호흡감지리드를 삽입할 필요가 없으며, 장치 수명이 경과하더라도 체내 배터리 교체 수술이 요구되지 않는다는 점에서 침습성을 크게 낮춘 것이 특징이다.
가장 최신버전인 Genio® System 2.1의 수술 시 사용되는 구성요소는 체내 삽입형 자극기(implantable stimulator), surgical template, external stimulator이며, 최종 위치 확인을 위해 AC/DP(activation chip/disposable patch) 조합을 사용하여 장치 활성화를 시행한다(Fig. 2). 체내 삽입형 자극기는 단일 절개를 통해 턱아래 중앙에 삽입되어 설하신경의 좌측 및 우측 내분지를 동시에 자극하도록 설계되었다(Fig. 2). 이설근(genioglossus muscle) 위에 안장 형태로 위치하도록 고안된 체내 삽입형 자극기는 중앙에 무선 에너지 수신 안테나(energy receiving antenna)와 전기회로(electrical circuit)를 포함하며, 이는 모두 세라믹 하우징(ceramic housing)에 밀폐(encapsulation)되어 있고 양측에는 각각 두 개의 전극으로 구성된 측면 paddle이 부착되어 있다(Fig. 2). Paddle 전극은 이설근을 가로지르는 설하신경의 양측 내분지(medial branch)를 향하도록 설계되어 있다.
Genio® System은 설하신경의 양측 가지를 동시에 자극하는 양측(bilateral) 신경자극 설계를 기반으로 하며, 이는 혀의 전방 이동 및 기도 개방을 보다 대칭적이고 효율적으로 유도할 수 있다는 이론적 장점이 있다.4) 또한 Genio® system은 1.5T 및 3T 전신 MRI(magnetic resonance imaging) 촬영이 가능한 MRI 완전 호환성(MRI conditional)을 갖추고 있어, 장기 관리 과정에서 영상검사 제한이 적다는 임상적 이점이 있다. 수술 절차 또한 단일 절개 기반으로 간소화되어 기계적 리드 고장이나 리드 마이그레이션과 같은 기존 시스템의 대표적인 기기 관련 문제가 상대적으로 적을 수 있다.
전체적인 술식을 보면 일반적으로 Inspire® upper air-way stimulation system의 여러 구성요소 중 자극리드(stimulation lead)를 가장 먼저 삽입하는 것을 권장한다. 우측 악하부에 넣어 준 자극리드를 설하신경의 내분지와 연결한 후 우측 흉부에 체내 삽입형 펄스 발생기(IPG)를 삽입할 흉부 피하 포켓(subcutaneous pocket)을 만들어 준다. 자극리드의 커넥터(connector end)를 피하 터널링(tunneling)을 통해 IPG가 위치한 포켓으로 넣어준다. 수면 중 흡기 시점의 압력변화를 감지할 호흡감지리드(respiratory sensing lead)를 우측 흉부 늑간에 삽입하고 호흡감지리드의 커넥터를 IPG 포켓까지 터널링하여 넣어준다. 자극리드와 호흡감지리드의 커넥터를 IPG 본체에 연결한 뒤, IPG를 흉부의 피하 포켓 내에 단단히 고정함으로써 이식 과정을 마무리한다.2,5)
수술은 주로 전신마취 하에 시행하며, 술 중 설하신경 분지의 기능적 반응을 평가해야 하므로 근이완제는 단시간 작용하는 약제로 필요시에만 매우 제한적으로 사용한다. 환자 체위는 어깨 롤을 이용한 경부 신전 자세를 취하며, 이는 수술 중 악하부의 노출을 용이하게 한다. 자극리드와 IPG는 주로 환자의 우측에 삽입하지만, 좌측 이식도 가능하며 심박조율기 등 기기적 요소를 고려하여 결정한다. 수술 중 설하신경의 내분지와 외분지를 확인하고 평가하기 위해 세 개의 신경 모니터링 리드를 사용한다. 혀 근육의 움직임에 관여하는 신경 모니터링을 위한 두 개의 구강 내 전극은 혀 외측(lateral aspect of tongue) 표층과 구강저(floor of mouth)에 각각 삽입하고 접지전극은 흉골(sternum)이나 좌측 어깨에 위치시킨다.
우측 악하부 내의 설하신경을 확인한 후 자극리드의 커프(cuff) 전극을 설하신경의 내분지와 연결해야 한다. 이를 위한 피부절개는 우측 하악하연 1 cm 아래에서 중앙(midline)으로 부터 5–10 mm 후방지점부터 자연스러운 피부 주름을 따라 5 cm 길이로 시행한다. 해당 위치는 설하신경 및 설하신경 동반정맥(ranine vein)을 일관성 있게 노출하는데 도움을 준다. 해당 절개선을 따라서 피부와 피하조직을 절개하여 들어가면서 광경근(platysma muscle)까지 확인 후 광경근을 절개하고 절개선의 전방과 상방으로 주변조직과의 박리를 진행한다.
악하부 내에서 자극리드와 연결될 설하신경을 안전하고 정확하게 노출하기 위한 주요 해부학적 지표로는 뒤쪽으로 악하선(submandibular gland)의 전연, 아래쪽으로 이복근(digatric muscle)의 중간건(intermediate tendon), 앞쪽으로 하악설골근(mylohyoid muscle) 등이 있다.
이복근의 전복(anterior belly of digastric muscle)은 이 과정에서 반드시 찾아야 하는 첫 번째 주요 해부학적 구조물이다. 이복근의 전복을 확인한 후에는 이를 따라서 설골(hyoid bone)를 향해 아래쪽 후방으로 내려가면 이복근의 중간건에 도달하게 되며, 이때 이복근과 중간건에 대한 과도한 박리는 필요하지 않다. 중간건이 확인되면 이를 아래쪽(inferior)으로 견인하여 수술 시야를 확보하게 되는데, 이때 vessel loop을 이용하여 견인하거나, 혹은 중간건 자체에 5 mm 간격으로 2–0 혹은 3–0 silk 봉합사 두 개를 걸어 견인 및 지지에 활용할 수 있다. 이 두 개의 봉합사는 초기에는 견인 용도로 사용되지만, 이후 자극리드(stimulation lead)를 고정(anchor) 하는 지지점으로 활용할 수 있다.
이복근의 중간건을 하방으로 견인하면 악하선의 전연(anterior border)을 확인할 수 있다. 설하신경은 악하선의 전방 및 심부(anterior and deep)에 위치하므로, 악하선 자체에 대한 박리는 최소한으로 하면서 악하선을 Army-Navy 리트랙터를 이용하여 후방으로 견인하면, 수직 방향으로 주행하는 하악설골근 근섬유(mylohyoid muscle fibers)를 확인할 수 있다. 이때 하악설골근의 후연(posterior extent)을 정확히 확인하는 것이 중요한데 이를 제대로 확인하지 않고 잘못 절개하면 설하신경에 대한 수술시야가 왜곡되고 불필요한 출혈 가능성이 증가할 수 있다.
하악설골근의 후연을 정확히 노출한 뒤 이를 전방으로 조심스럽게 견인하면서 설하신경을 확인한다. 이때 설하신경의 동반정맥(vena comitans of the hypoglossal nerve, ranine vein)을 설하신경에 대한 해부학적 표지자로 활용할 수 있다. Ranine vein은 설하신경보다 표층에서 평행하게 신경의 하방을 따라 주행하며 가능한 보존하지만 필요시 결찰 후 절제할 수 있다. 만약 ranine vein이 보이지 않는데도 신경이 관찰되고, 신경자극기(nerve stimulator)에 반응하지 않는다면 이는 설신경(lingual nerve)일 가능성이 높으며, 특히 고령 환자에서 흔히 관찰된다. 이러한 경우 박리 범위를 아래쪽(inferior direction)으로 이동하면서 설하신경의 실제 주행 여부를 확인해야 한다.
설하신경을 명확히 확인하고 ranine vein에 대한 처치를 완료한 후에는, 설하신경의 외분지와 내분지의 분기점(breakpoint)을 식별하는 과정으로 넘어간다. 일반적으로 신경이 나누어지는 지점은 설하신경의 상부 1/3과 하부 2/3가 만나는 지점에서 지나가는 신경 주행을 따라 동반되는 소혈관(vasa nervorum)에 의해 확인되는 경우가 가장 많다. 이 부위는 자극커프(stimulation cuff)의 배치를 위한 해부학적 기준점으로 중요한 의미를 갖는다. 분기점으로 추정되는 부위를 중심으로 미세 겸자(fine hemostat) 등을 이용해 설하신경 심부(deep)에 위치한 설골설근(hyoglossus muscle)이 확인될 때까지 박리한다. 현미경하에서 신경 분기점의 위치가 시각적으로 추정되면, 신경자극기(nerve stimulator)를 이용하여 내분지 자극시 이설근(genioglossus)의 전방 운동이 적절히 유발되는지 확인함으로써 해당 위치가 정확한지 판단할 수 있다. 분기점이 확인되면, 미세우각(micro right-angle) 겸자를 이용하여 커프 배치 예정부위인 커프 윈도우(cuff window)안의 신경아래로 vessel loop을 통과시켜 걸어준다. 이 과정에서 설하신경의 내분지를 vessel loop로 가볍게 들면서, 커프 윈도우의 원위(distal) 및 상방(superior) 경계를 면밀히 관찰하고 신경 자극을 하면서, 일부 환자에서 존재하는 후발성(late) retractor branch의 유무를 확인한다. 만약 이러한 늦게 분지하는 retractor branch가 확인되면, 해당 분지를 따라 추가 박리를 시행하고, 이 분지가 커프 윈도우에는 포함되지 않도록 vessel loop를 다시 위치시켜야 한다.
커프 배치에 앞서 확인해야 할 핵심 요소로 커프 윈도우가 충분한 크기인지 여부와 C1 신경으로 가는 설하신경 가지(hypoglossal branch to C1)를 포함할지 여부를 결정해야 한다. 가능한 설하신경에서 C1으로 향하는 분지는 신경의 하방에서 자극 커프에 포함시키는 것이 권장된다. 다만 해당 분지의 해부학적 위치가 커프 삽입을 방해하는 경우에는 제외할 수 있다. 커프 윈도우는 신경을 덮고 있는 근막을 분리하고, 원하는 범위 내에서 신경과 평행하게 섬세하게 박리함으로써 확장할 수 있다. 최종적으로 배치되는 커프의 길이는 약 1 cm이며 이 길이를 충분히 수용할 수 있는 안정된 윈도우 확보가 필수적이다.
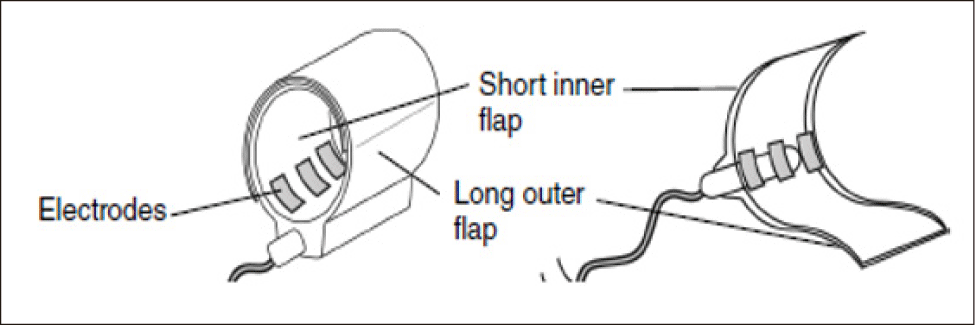
커프 윈도우의 해부학적 및 기능적 확인이 모두 완료되어 분기점 부위에 대한 확신이 있으면, 자극커프(stimulation cuff)를 배치한다. 자극커프는 짧은 안쪽 플랩과 긴 바깥쪽 플랩으로 구성되어 있으며, protrusor branch인 설하신경의 내분지를 감싸도록 배치한다(Fig. 3). 이를 위해서 미세우각겸자를 신경하방으로 통과시킨 후 긴 바깥쪽 플랩을 잡아 신경아래로 부드럽게 당겨서 신경의 하측면을 따라서 감싸질 수 있게 빼주고, 짧은 안쪽 플랩은 열린 상태로 유지한다. 이후 짧은 플랩을 신경 주위를 감싸듯이 돌려 씌우고, 이후 긴 바깥쪽 플랩을 그 위로 덮어 두 플랩이 신경을 완전히 감싸도록 한다(Fig. 4). 마지막으로 전극과 신경 사이의 전기적 접촉을 최적화하기 위해 멸균 생리식염수로 커프와 신경을 세척한다.
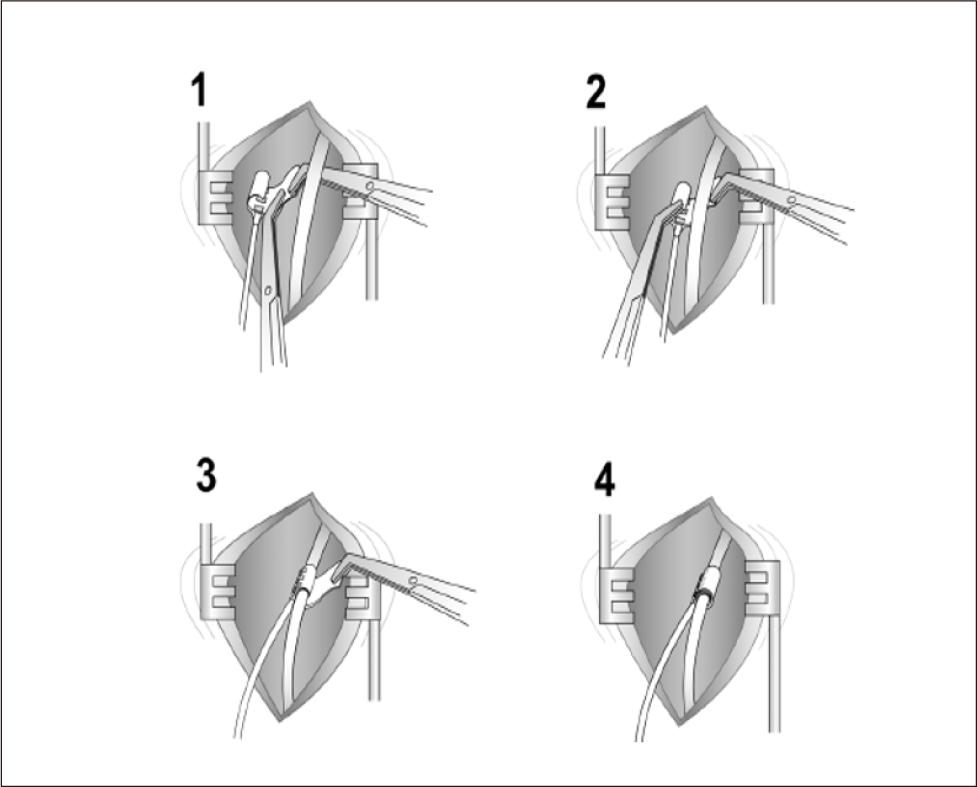
자극리드와 커프가 적절히 자리를 잡으면, 다음 단계로 체내 삽입형 펄스 발생기(IPG)와의 연결 및 수술 중 자극 테스트를 시행한다. 우선, IPG 치료(IPG therapy) 기능이 꺼져 있는지 확인하고 자극리드(stimulation lead) 커넥터(connector)를 IPG 본체의 “STIM” 표시가 있는 커넥터 포트에 삽입한다. IPG가 연결되면, 의사용 프로그래머(physician programmer)를 이용해 초기 자극 설정을 시행한다. 보통 0.5 V에서 시작하여 0.2 V 단위로 점진적으로 증가시키며 자극 반응을 평가하는 것이 권장된다. 이때 혀(tongue)와 경부(neck) 주변 근육의 움직임을 면밀히 관찰하여 자극에 대한 적절한 근수축 반응이 나타나는지 확인한다. 자극에 따른 반응이 목표 근육에서 적절히 나타나야 하며, 만약 반응이 불충분하거나 비정상적이라면 리드 위치를 미세 조정(repositioning)한다. 리드 위치를 재조정하는 동안, 커프와 신경 사이의 전기적 접촉을 개선하기 위해 멸균 생리식염수(sterile saline)를 커프 주변에 적절히 뿌려주는 것이 도움이 된다. 만약 반복적인 조정에도 적절한 자극 반응이 유발되지 않으면, 커프의 위치를 다시 확인하고 필요시 추가로 위치조정을 시행한다. 모든 자극 테스트가 완료되면 수술 중 불필요한 자극이 발생하지 않도록 종료 전에 IPG 치료기능이 오프 상태로 되어 있는지 확인하고 자극리드 커넥터를 IPG로부터 조심스럽게 분리한다.
신경에 불필요한 긴장이나 회전을 유발하지 않도록 커프와 리드 본체를 설하신경과 평행하게 유지하고 커프와 고정 지점 사이에 충분한 여유 루프(lead loop)를 만들어주어 리드에 비틀림이나 장력이 전달되지 않도록 한다. 커프의 spine(커프 후방 구조물)은 가능한 한 신경의 하방(inferior aspect)에 위치시키는 것이 바람직하다. 앵커에 존재하는 두 개의 고정 홈(anchor recesses)을 이용하여 영구 봉합사를 통과시키고, 이를 이복근에 봉합하여 리드를 견고하게 고정한다. 수술 초기 견인을 위해 중간건(intermediate tendon)에 걸어 두었던 봉합사가 있다면, 이를 재사용하여 동일한 방식으로 앵커 고정에 활용할 수 있다. 모든 시스템 구성요소가 삽입 및 테스트 완료되기 전까지는 경부 절개부를 봉합하지 않는 것을 권장한다. 수술 진행 중 멸균 생리식염수 혹은 항생제 용액에 적신 4×4 거즈로 절개부를 부드럽게 패킹해 둘 수 있고 봉합 전에 이를 제거할 때는 커프나 리드가 이탈되지 않도록 각별히 주의한다. 봉합사는 반드시 리드의 앵커 부분(anchor region)에만 적용하며, 리드 본체에는 봉합사를 걸지 않는다. 리드 본체는 외과 기구로 직접 취급하지 않는 것이 원칙이며, 과도한 굴곡이나 절연 피복 손상이 쉽게 발생할 수 있으므로 주의가 필요하다. 리드를 다룰 때는 가능한 손으로 부드럽게 조작해야 하며, 외과 기구는 리드 앵커(anchor) 부위를 취급하는 용도로만 제한적으로 사용하는 것이 권장된다.
IPG 포켓을 만들 때에는, 배낭 착용 습관, 직업적 활동 또는 여가 활동 등 환자의 생활 양식(lifestyle factors)을 고려하여 IPG의 위치가 일상생활에 불편을 주지 않도록 결정하는 것이 중요하다. 제2늑간 공간에 해당하는 위치를 찿기 위해 우측 쇄골 하연을 따라 세손가락을 나란히 놓았을 때 세 번째 손가락이 위치하는 지점에 흉골외측연에서 바깥쪽으로 2–3 cm 떨어진 위치에서부터 5 cm 길이의 수평절개를 넣고 대흉근(pectoralis major) 근막까지 찿아 들어간다. 근막층에 도달하면 근막아래에 손가락으로 둔상박리를 하여 근막하방에 약 4 cm(두 손가락 너비) 크기로 IPG 본체와 여분의 리드가 충분히 들어갈 수 있도록 넉넉한 피하 포켓을 만든다. 이때 팔 움직임으로 IPG가 쇄골 위로 올라가지 않도록 한다.
리드 터널링은 자극리드와 호흡감지리드 모두에 동일하게 적용되는 과정으로, 리드가 이식된 부위에서 IPG 피하 포켓까지 커넥터를 안전하게 이동시키는 것이 목적이다. 터널링 시 리드 본체에 급격한 굴곡이 발생하지 않도록 하는 것이 중요하며, 일반적으로 두 절개 사이에 추가 절개가 필요하지는 않다.
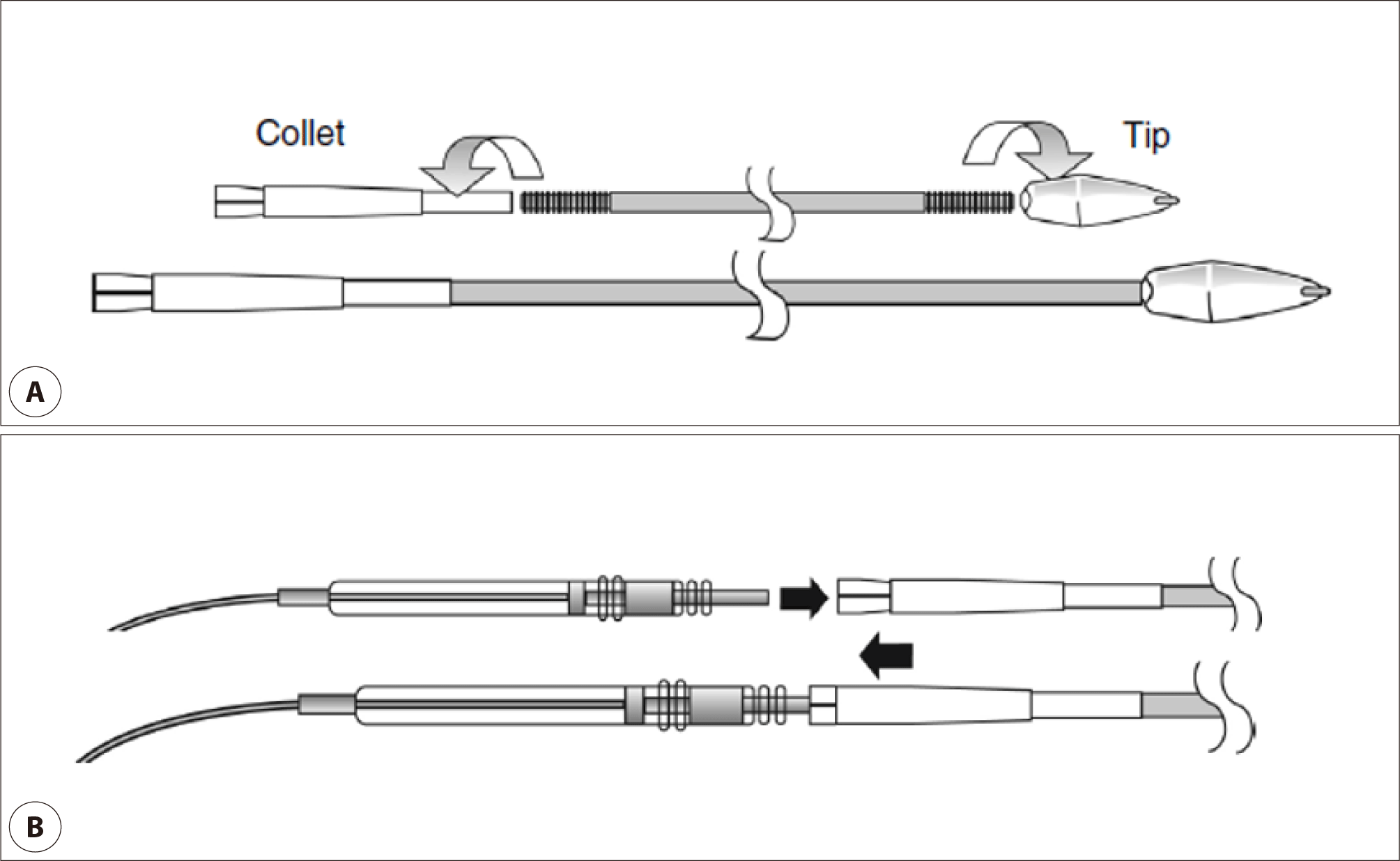
수술자는 먼저 멸균 상태의 터널링 기구를 준비하는데, 스테인리스 로드를 아치형으로 여러 차례 부드럽게 휘어 원하는 곡률을 형성한다. 터널링 기구의 팁(tip)을 먼저 로드에 연결하고, collet은 손상되는 것을 피하기 위해 터널 경로가 완전히 확보된 이후에만 부착한다(Fig. 5). 그 후 리드의 커넥터가 최종적으로 IPG 포켓에서 어떤 위치로 출구를 형성할지 미리 확인하고 적절한 터널 경로를 계획한다. 터널링은 리드 삽입 절개부에서 시작하여 피하층을 따라 IPG 포켓 방향으로 진행하며, 터널링 기구의 팁이 IPG 포켓 내로 자연스럽게 노출될 때까지 진행한다. 이 과정에서는 깊은 층으로의 진행은 피해야 하며, 과도한 힘이나 외과 기구를 통해 밀어 넣는 것은 리드 또는 조직의 손상을 유발할 수 있으므로 주의가 필요하다. 특히 자극리드의 경우 쇄골 하방으로 터널링하는 것은 혈관 손상의 위험을 높이므로 피해야 한다.
호흡감지리드(respiratory sensing lead)를 다룰 때에는, 리드의 감지센서가 열에 의해 손상될 위험이 있으므로 터널링 과정 또는 IPG에 연결되기 이전 단계에서 전기소작(electrocautery)의 사용을 피해야 한다. 만약 불가피하게 소작을 시행해야 하는 상황이라면, 리드가 IPG에 아직 연결되지 않은 경우 반드시 검은색 U자형 쇼팅 바(black U-shaped shorting bar)를 리드에 연결하여 전기적 손상을 방지해야 한다. 호흡감지리드(respiratory sensing lead)의 경우, 터널링을 시작하기 전에 커넥터에 장착되어 있던 쇼팅 바(shorting bar)를 먼저 제거한다. 자극리드(stimulation lead)는 이러한 과정 없이 바로 터널링 도구와 연결할 수 있다.
리드를 터널링 도구에 연결하기 위해서 collet 슬리브(sleeve)를 기구 끝부분(tunneling tool tip) 방향으로 내려서 collet을 열어준 후 리드 커넥터의 핀(pin)을 열려진 collet 안으로 넣어준다(Fig. 5). 커넥터가 정확히 자리 잡으면, 슬리브를 다시 collet 위로 밀어 올려 고정하는데, 가벼운 힘으로도 충분히 고정할 수 있다(Fig. 5).
터널링 도구가 IPG 포켓 내로 도달하면, 리드를 IPG 포켓의 출구(exit site)를 통해 천천히 견인하여 꺼낸다. 리드가 포켓 내로 완전히 이동한 뒤에는, 터널링 도구의 슬리브(sleeve)를 후방으로 밀어 collet을 개방함으로써 리드를 안전하게 분리한다.
호흡감지리드는 보통 우측 흉벽의 늑막외 공간(extra-pleural space)에 위치시키게 된다. 이를 위해 먼저 중액와선(midaxillary line) 부근에서 시작하여 늑골 방향(rib orientation)에 평행하게, 그리고 흉골 방향으로 향하는 약 4–6 cm의 피부 절개를 가한다. 호흡감지리드 원위부의 약 3–5 cm 정도가 늑간근(intercostal muscles) 사이에 들어가게 되므로, 절개선은 센서(sensor) 위치로부터 동일 거리만큼 외측으로 떨어진 곳에 위치시키는 것이 적절하다. 일반적으로 유두선(nipple line)과 동일한 수평선이 센서의 이상적 위치가 된다.
절개 후에는 예리박리(sharp dissection)와 둔성박리(blunt dissection)를 병행하여 늑간근층을 노출시킨다. 먼저 외늑간근(external intercostal muscle)을 찿고, 더 깊은 층에 위치한 내늑간근(internal intercostal muscle)을 확인한다. 외늑간근은 매우 두꺼운 근막을 가지며 근섬유 방향은 상외측(superiolateral)에서 하내측(inferiomedial)으로 주행한다. 박리를 더욱 안쪽으로 진행하면 내늑간근과 만나게 되며, 내늑간근은 외늑간근과 유사하나 근섬유 방향이 서로 수직이 되는 상내측(superiomedial)에서 하외측(inferiolateral) 방향으로 주행한다. 내늑간근 바로 아래에는 벽측 흉막(parietal pleura)이 위치하고 손상 시 기흉을 유발할 수 있어 세심한 주의가 필요하다.
감지센서는 내늑간근과 외늑간근 사이의 평면(intermuscular plane)에 삽입하며, 이 공간이 신호 전달 및 리드 안정성 측면에서 가장 적합한 위치이다. 늑골 바로 하방에는 신경혈관다발(neurovascular bundle)이 존재하므로, 가능한 한 늑골의 상연(superior surface)에 가깝게, 즉 신경혈관다발을 피해 늑골 위쪽 공간에 삽입하는 것이 안전하다. 센서배치는 해부학적 접근성 및 감지 신호의 안정성을 고려하면 제4 또는 제5 늑간이 가장 선호된다. 감지리드 삽입시 원위부의 압력감지막(sensor membrane)은 반드시 흉막(pleura)을 향하도록 배치해야 한다.
호흡감지리드가 적절히 배치되면, 리드는 두 개의 앵커(anchor)로 고정한다. 각 앵커에는 두 개의 winglet과 두 개의 고정 홈(grooves)이 있어, 이를 이용하여 영구 봉합사로 리드를 견고하게 고정한다. 이 과정에서도 압력감지막의 방향이 유지되는지 지속적으로 확인해야 한다. 원위부 앵커는 리드 본체에 고정되어 있으나, 근위부(proximal) 앵커는 위치 조정이 가능하므로, 필요 시 생리식염수를 사용하여 리드 표면을 적셔 앵커의 이동을 용이하게 한 후 IPG 포켓 방향으로 리드가 자연스럽게 향하도록 위치시킨다.
앵커 고정이 완료되면, 앵커 자체를 피하조직(subcuta-neous tissue)에 봉합하여 최종적으로 고정한 뒤, 리드 본체가 늑간 근육층을 빠져나오는 부위에서 IPG 포켓 방향으로의 전환이 부드럽게 이어지는지 확인한다. 이후 터널링 도구(tunneling tool)를 사용하여 리드 커넥터를 IPG 포켓으로 견인함으로써 연결 준비를 마친다.
호흡감지리드는 흉곽 팽창과 수축을 감지하여 IPG에 흡기 시점을 전달하는 역할을 하며, 이를 통해 자극이 호흡 리듬과 동기화된 방식(respiratory-synchronized stimulation)으로 제공된다. 이러한 동기화는 불필요한 자극을 줄이고 치료 효율을 높이는 데 중요한 요소이다. 다만, 최근 출시된 Inspire V 버전에서는 호흡감지전극의 구조가 IPG와 통합 및 단순화되면서 별도의 호흡감지리드의 삽입이 불필요하게 되었다.3)
호흡감지리드(respiratory sensing lead)는 IPG의 SENSE 포트에 연결되어 작동을 하게 된다. 리드 연결 전에 우선 커넥터(connector)에 묻어 있는 체액이나 혈액을 완전히 닦아내어 접촉 장애가 없도록 한다. 이후 커넥터 말단에서 약 3 cm 지점을 잡고, 리드 커넥터의 핀(pin)이 IPG의 SENSE 포트 내부 후벽까지 완전히 도달하도록 주의 깊게 삽입한다. 이는 정확한 신호 전달과 기기 안정성을 위한 필수 확인 과정이다.
리드가 올바르게 삽입되면, 육각 렌치(hex wrench)를 사용하여 SENSE 포트 양측에 위치한 두 개의 세트스크류(setscrews)를 순서대로 조인다. 먼저 리드 포트에서 멀리 떨어진 세트스크류를 조여 초기 고정을 확보한 뒤, 리드를 가볍게 당겨 첫 번째 스크류에 의해 리드가 안정적으로 고정되었는지 확인한다. 그 다음 리드 포트에 가장 가까운 세트스크류를 조이고, 저항을 느낀 후 추가로 1/4 회전 정도만 더 조여 과도한 압박으로 인한 손상이 발생하지 않도록 한다.
두 개의 세트스크류가 모두 조여지면, 스크류 상부의 실(seal)이 완전히 닫혀 있는지 다시 확인하여 체액 및 이물질 유입을 예방한다. 이러한 일련의 과정은 센서 리드의 안정적인 작동과 장기적인 기기 성능 유지에 필수적이다.
호흡감지리드가 IPG에 연결된 후에는 즉시 기능을 확인한다. 먼저 텔레메트리 케이블을 멸균 슬리브에 삽입한 뒤, 텔레메트리 헤드를 IPG 상부의 중심에 정확히 위치시킨다. 그 다음 프로그래머(programmer)를 이용하여 센서 파형(sensor waveform)이 정상적으로 감지되는지를 확인함으로써 센서 기능을 평가한다. 기능이 적절하게 확인되면, 테스트 종료 후 치료 모드를 다시 꺼서 마무리한다.
자극리드(stimulation lead)를 IPG에 연결하기 전에, 우선 커넥터(connector) 표면에 묻어 있는 혈액이나 체액을 완전히 제거하여 접촉 저항이나 연결 장애가 발생하지 않도록 한다. 이후 커넥터 말단에서 약 3 cm 지점을 잡고, 리드 커넥터의 핀(pin)이 IPG의 STIM 포트(STIM port) 내부 후벽까지 완전히 닿도록 주의 깊게 삽입한다. 커넥터 핀의 완전 삽입 여부는 안정적인 전기적 접촉 및 자극 전달을 위한 필수 확인 사항이다.
리드가 정확히 삽입되면, 육각 렌치를 이용해 STIM 포트 양측에 위치한 두 개의 세트스크류(setscrews)를 순차적으로 조여 고정한다. 먼저 리드 포트에서 가장 먼 위치의 세트스크류를 조여 초기 고정을 확보하고, 그 상태에서 리드를 가볍게 당겨 첫 번째 스크류가 리드를 안정적으로 잡고 있는지 확인한다. 이후 리드 포트에 가장 가까운 두 번째 세트스크류를 조이되, 저항이 느껴진 뒤 약 1/4 바퀴 정도만 추가로 조여 과도한 압박으로 인해 리드가 손상되지 않도록 한다.
두 스크류 모두 고정이 완료되면, 세트스크류 상부를 덮고 있는 실(seal)이 완전히 닫혀 있는지 확인하여 체액이나 이물질의 유입을 방지한다.
IPG를 삽입할 때에는 배낭(backpack) 착용 습관, 직업적 활동 또는 운동 · 레저 활동 등 환자의 생활양식(lifestyle factors)을 고려하여, 일상적인 팔 움직임이나 흉부 압박으로 인해 IPG가 불편을 일으키지 않도록 적절한 위치를 선정해야 한다.
IPG 포켓이 형성되면, 터널링을 통해 전달된 리드의 여유 길이(excess lead)는 IPG 후방으로 부드럽게 감아(wrap) 정리한 뒤, IPG 본체와 함께 포켓 내부에 위치시킨다. 이때 리드를 동그랗게 말아(coiling) 포갠 형태로 넣는 것은 금기이며, 리드가 겹치거나 압박되는 형태는 장기적으로 리드 손상 및 신호 장애를 유발할 수 있으므로 피해야 한다. IPG는 제조사 로고가 피부 방향으로 향하도록, 즉 로고 면이 상방(skin side)을 향하게 삽입한다.
IPG가 자리 잡으면 프로그램 장치(physician progra-mmer)를 이용하여 시스템 기능을 확인한다. 기능 평가는 자극리드(stimulation lead)와 호흡감지리드(respiratory sensing lead) 모두에 대해 수행하며, 자극리드는 혀 및 경부 근육의 자극 반응(stimulation response)을, 감지리드는 프로그래머 상에서 센서 파형(sensor waveform)이 정상적으로 검출되는지 확인함으로써 검증한다.
시스템 기능이 정상적으로 확인된 뒤에는, 치료 모드(therapy)가 꺼져 있는지, 그리고 자극 강도(stimulation amplitude)가 0 V로 설정되어 있는지 다시 한번 확인해야 한다. 자극리드(stimulation lead)가 주변 조직에 치유 및 피막 형성(encapsulation)과정을 거쳐 안정적으로 자리 잡을 시간을 제공하기 위해서 수술 직후 첫 한 달 동안은 자극 치료를 활성화하지 않는 것이 권장된다.
시스템 기능이 정상적으로 확인되면 IPG 고정 및 절개부 폐쇄 과정을 포함하여 수술을 마무리한다. 먼저, IPG는 본체에 마련된 두 개의 봉합공(suture hole) 중 하나를 이용하여 근막(fascia)에 영구 봉합사로 고정한다. 이때 근육층보다는 근막에 고정하는 것이 기기의 안정성과 장기적인 위치 유지에 유리하다. IPG와 리드 배치가 완료되면, 모든 절개 부위는 bacitracin과 생리식염수 또는 이에 준하는 용액으로 충분히 세척하여 감염 위험을 최소화한다. 이후 표준적인 방식으로 절개창을 층별로 봉합한다. 필요한 경우, 술자의 판단에 따라 수술 후 항생제를 투여할 수 있다.
수술 후 환자는 일반적으로 당일 퇴원 또는 1박 입원이 가능하며, 초기 회복 기간 동안에는 IPG가 비활성 상태로 유지된다. 상처 치유 및 섬유화 고정이 충분히 이루어지는 4주 후 기기 활성화를 시행한다. 활성화 세션에서는 자극 강도, 펄스폭(pulse width), 주파수(frequency) 등을 조정하며, 이후 수면다원검사(polysomnography, PSG) 기반 titration을 통해 개별 환자에게 최적화된 자극 세팅을 확립한다. 자극 세팅은 초기 1–3개월 동안 여러 차례 방문을 통해 미세 조절되며, 이후 치료 반응에 따라 6–12개월 주기 추적관찰이 이루어진다. 장기적으로 IPG의 배터리 수명은 약 10년으로 알려져 있으며, 배터리 소진 시 교체 수술이 필요하다.
Genio® system은 양측(bilateral) 설하신경(hypoglossal nerve)의 내분지를 자극하기 위해 설계된 리드리스(lead-less) 신경자극 기기로, 기존 상기도신경자극술과 달리 체내 배터리 또는 호흡감지리드를 필요로 하지 않는 것이 특징이다. 수술은 소형 신경자극 모듈을 하악부 전방에 단일절개를 통해 직접 이식하는 방식으로 이루어지며, 절개 수와 기기 구성요소가 단순하여 Inspire® upper airway stimulation system에 비해 수술이 침습도가 낮다.4,6)
환자는 앙와위에서 어깨 롤을 이용하여 경부 신전 상태를 유지한다. 설하신경의 내분지 자극에 따른 근반응 확인을 위해 양측 이설근(genioglossus muscle) 및 경돌설근(styloglossus muscle)에 bipolar EMG 전극(bipolar stimulator probe [NIM] 3.0, Medtronic)을 삽입한다. 구강은 측방으로 거즈 롤을 위치시켜 개방하고, 비강내시경을 통해 자극 시 설기저부(tongue base)와 후두개(epiglottis) 움직임을 관찰한다.
설골(hyoid bone), 하악골(mandible), 그리고 멘툼(mentum)에서 설골까지 이어지는 정중선(midline)을 정확히 확인한다. 이후 설골 위치로부터 약 1 cm 상방에서, 정중선을 기준으로 좌우 약 3 cm 범위를 포함하는 6 cm 길이의 피부 절개를 한다. 절개부의 위치와 정중선 유지가 중요하므로, 수술 전 피부 표식으로 해부학적 구조물들을 명확히 표시한다.
피하조직을 거쳐 광경근(platysma)을 분리한 뒤, 상 · 하방으로 피하 피판(subplatysmal flaps)을 형성한다. Subplatysmal flap은 아래는 갑상연골 상부까지, 위는 턱끝까지 만들어 준다. 필요시 이복근(digastric muscle)이 시야에 노출되면 양측으로 부드럽게 견인하여 수술 시야를 확보한다. 이어 중앙(midline)에서 하악설골근(mylohyoid muscle)을 절개하면 그 아래 수직섬유를 가진 이설골근(geniohyoid muscle) 근육이 노출된다. 이설골근을 정중앙선에서 절개한 후 양측으로 분리해 후방으로 견인하면, 그 심부에서 이설근(genioglossus muscle)이 확인된다.
이설근 양측 외측 경계를 따라 지방층을 조심스럽게 박리하면서 설하신경(시상면에서 상내측 방향으로 이설근을 향해 60°로 주행)의 분지들을 노출시킨다. 수술 중 신경감시장치(intraoperative neuromonitoring)를 이용하여 자극에 따른 실시간 근수축 반응을 보면서 설하신경의 주간(main trunk)을 정확히 확인한다. 주간이 확인되면 이를 따라서 원위부(distal)로 추적하면서 이설근으로 진입하는 내분지(medial branch)를 확인한다. 설하신경 여부와 위치를 정확히 확인하기 위하여 신경자극기를 0.5–1.0 mA에서 시작하여 탐지한다. 내분지 자극 시 이설근의 수축과 해당 근섬유의 신경감시장치 활성화가 나타나며, 반대로 외분지 자극 시 설골설근(hyoglossus muscle) 및 경돌설근(styloglossus muscle)의 수축과 해당 신호가 관찰된다.
신경 상방으로 박리를 진행하면서 설하신경의 내분지와 가장 원위부의 외 분지 사이에 이설근의 양측 외연을 따라 체내 삽입형 자극기(implantable stimulator)의 전극패들(electrode paddles)이 삽입될 충분한 깊이의 pocket 공간을 만들어 준다. 이때 전극패들이 가능한 내분지를 향해 배치되면서 무리한 장력을 받지 않고 자연스럽게 위치할 수 있도록 신경 상방에 충분한 공간을 확보해야 한다. 동일한 과정을 좌 · 우측 신경 모두에서 시행한다.
Genio® system의 체내 삽입형 자극기(implantable stimulator)는 중앙의 수신 안테나와 좌우로 펼쳐지는 2개의 다리(legs)로 이루어져 있으며, 각 다리에는 한쌍의 전극패들이 있다. 자극기 취급 시 전극 부위를 손으로 직접 접촉하거나 날카로운 기구를 사용하지 않도록 주의한다.
이설근(genioglossus muscle) 위에 자극기를 평평하게 배치하고, 양측 패들(paddle)이 사전에 형성된 해부 공간에 정확히 위치하도록 한다. 각 패들에 포함된 두 개의 전극은 설하신경 내분지(medial branch)의 말단 신경섬유(terminal fibers)를 향하도록 배치한다. 양측성 자극(bilateral stimulation)이 되도록 기기 본체(implantable stimulation unit)는 midline에 삽입되며, 기기 양쪽에 배치된 두 개의 전극패들를 각각 좌 · 우측 설하신경 내분지가 지나는 부위에 근접시킨 상태로 고정한다. 이때 특정 신경 분지를 직접 cuff로 감싸는 방식이 아니라, 근막층에 고정된 전극 패드를 통해 비접촉형 형태로 자극을 전달하도록 설계되어 있어, 신경미세해부가 필요하지 않다는 점이 기존 방식과의 가장 큰 차이 중 하나이다. 또한 세라믹 하우징(ceramic housing)은 하악골(mandible)에 닿지 않도록 하면서 턱의 전방(anterior chin) 방향을 향하도록 배치한다.
리드를 사용하지 않는 구조이기 때문에, 각 다리(leg)에 있는 4개의 suture hole을 통하여 2-0 비흡수성 봉합사를 이용해 이설근 근육 표층의 근막층(fascia)을 포함하는 연부조직에 고정하며, 양측 전극이 대칭적으로 위치하는지와 기기 본체가 midline에서 벗어나지 않았는지 확인한다. 봉합 시 봉합사는 기기를 먼저 통과한 뒤 근육을 통과하도록 하고, 근손상을 최소화하기 위해 소량의 근층만 포함한다. 동일한 절차를 양측에 시행한다.
체내 삽입형 자극기가 적절히 위치하면 외부 자극기(exter-nal stimulator)를 체내 삽입형 자극기 안테나 위에 밀착시켜 전력을 전달해 시험자극을 가한다. 시험자극시 이설근 전극에서는 고진폭(high amplitude), 경돌설근 전극에서는 저진폭 반응을 확인한다. 대칭적 이설근 전방수축이 확인되면 적절한 위치로 판단할 수 있고 고정단계로 진행한다. 적절한 자극 반응이 나타나지 않거나 20% 이상의 자극 강도가 필요할 경우, 자극기의 위치를 재조정한 뒤 다시 반복하여 확인한다. 적절한 자극 반응의 기준은 혀가 비틀림이나 후방견인 없이 좌우 대칭적으로 전방으로 돌출되고, 하악 전치(lower incisors)를 넘어가는 것이다.
양측 고정이 완료되면 절개를 임시 봉합한 뒤, 피부 위에 AC와 DP를 부착하여 무선 자극 테스트를 시행한다. 비강내시경을 이용해 설기저부 및 후두개의 전진 및 개방 정도를 관찰하여 체내 삽입형 자극기의 최종 위치를 확인한다. 이후 절개부를 다시 개방하여 이설골근을 재접합하고, 하악설골근 및 활경근(platysma)을 각각 해부학적 층 구조에 따라 복원한다.
체내 삽입형 자극기(implantable stimulator)의 세라믹 하우징(ceramic housing)과 피부 사이의 거리를 측정하여 3 cm 이내인지를 확인한다. 이 거리가 3 cm를 초과할 경우, 술 후 활성화 시 자극 전달이 원활하지 않거나 더 높은 자극 강도가 필요할 수 있다. 이러한 상황에서는 술자의 판단에 따라 표준적인 지방절제술(lipectomy)을 시행하여 피하 지방층을 감소시키되, 최소 2 cm 이상의 거리는 유지하도록 한다. 피부봉합은 술자의 선호도와 임상상황에 따라서 일반적인 표준 봉합법으로 시행하고 물이 들어가지 않도록 방수 드레싱을 적용한다.
기기의 활성화는 수술 후 약 6주 시점에 시행되며, 환자는 취침 시 턱 아래에 외부 웨어러블 패치형 활성화 칩을 부착하여 자극을 구동한다. 활성화 과정에서는 양측 자극 강도, 펄스폭(pulse width), 주파수 등을 개인별로 조정한다.
전통적 Inspire 시스템은 설하신경의 내분지를 선별적으로 자극하기 위한 다중 구성요소 기반 시스템으로, 자극리드, 흉벽 호흡감지리드, 그리고 체내 삽입형 펄스 발생기(IPG)의 세 부품을 각각 이식하는 비교적 복합적인 술식을 요구한다. 수술은 우측 턱 아래(submandibular)에서 설하신경 분지를 미세해부하여 cuff형 자극리드를 직접 감싸는 과정, 늑간(intercostal space)을 통한 호흡감지리드 삽입, 그리고 쇄골하(subclavicular) IPG 이식의 세 단계로 구성되며, 세 곳의 절개와 정교한 신경 박리 과정이 필요하다.
가장 최신 버전인 Inspire V 시스템은 이전 세대 Inspire의 구조적 원리를 유지하면서도 수술 과정의 단순화와 기기 구성 요소의 최적화를 목표로 설계되었다. Inspire V는 호흡감지리드 기능이 IPG와 통합형 구조로 재설계되면서 별도의 호흡감지리드 삽입이 생략될 수 있어, 절개 수와 수술 시간을 줄이는 것이 가능해졌다. 또한 IPG 크기 및 삽입 위치 선택 폭이 넓어지고 블루투스 기반 프로그래머가 도입되어 술 후 조정(titration) 과정도 효율화된 것이 특징이다. 그러나 설하신경의 내분지를 cuff로 감싸는 기본 원리는 기존 Inspire와 동일하여, 여전히 신경분지의 직접적 노출 및 섬세한 박리가 필요하다는 점에서 구조적 기반은 유지된다.
반면 Genio® system은 구조적 · 술기적 접근 방식에서 두 Inspire 시스템과 근본적으로 다른 플랫폼을 제시한다. Genio® System은 리드리스(lead-less) 방식의 단일절개 기반 이식술로, 양측성(bilateral) 자극을 구현하기 위해 하악 전방 근막층(fascial plane)에 얇은 패들형 전극을 양측 대칭으로 고정하고, 중간(midlne)에 소형 자극 모듈을 삽입한다. 설하신경을 직접 박리하여 cuff를 감싸는 방식이 아니므로 미세신경해부가 필요하지 않으며, 호흡감지리드나 체내 배터리도 삽입하지 않는다. 수면 시 부착하는 외부 활성화 칩(activation chip)에서 무선으로 에너지를 전달받기 때문에 장기적 배터리 교체 수술이 필요 없고, 전체 수술 침습도는 세 기기 중 가장 낮다.
기존 Inspire는 복합 구성요소 기반의 고전적 신경자극 이식술이며, Inspire V는 동일한 원리를 유지하되 구조적 · 절차적 간소화를 통해 수술 부담을 줄인 진화형 모델이다. 반면 Genio® System은 단일 절개, 리드리스, 양측성 자극, 외부 에너지 전달 시스템이라는 완전히 다른 수술 철학을 기반으로 하여 침습도를 크게 낮춘 플랫폼이다. 이러한 세 기기의 차이는 환자의 해부학적 특성, 동반질환, 장기 추적의 용이성, 수술 접근성 등을 고려한 기기 선택 과정에서 중요한 판단 요소가 된다.
설하신경자극술 중에서 Inspire® upper airway stimula-tion system은 미국 FDA에서 2014년 5월에 승인된 중등도에서 중증의 폐쇄성수면무호흡증(OSA) 환자 중 일부에서 선택적으로 적용할 수 있는 치료법이다.2) 미국 FDA에서 2023년 6월에 확대된 적응증에 따르면 적응 대상은 22세 이상의 성인에서 무호흡-저호흡 지수(apnea–hypopnea index, AHI)가 15 이상 100 이하인 환자 중, BMI≤40 kg/m²이며 지속적양압호흡기(continuous positive airway pressure, CPAP) 또는 이중양압호흡기(bilevel PAP, BPAP) 치료에 실패하거나 순응하지 못하는 환자 중에서 수면내시경(drug-induced sleep endoscopy, DISE)에서 구개부 완전 원형폐쇄(complete concentric collapse, CCC) 가 없는 경우에 해당한다.7)
PAP 치료 실패(PAP failure)는 적절한 치료에도 불구하고 AHI가 15 이상으로 남아 있는 경우를 의미하며, PAP 불내성(PAP intolerance)은 다음 두 가지 중 하나에 해당한다. 1) PAP을 주당 5일 이상, 하루 4시간 이상 사용할 수 없는 경우, 2) 사용 불편감이나 거부감으로 인해 기기를 반납하거나 더 이상 사용하지 않는 경우이다.
최근 FDA에서는 관련된 연구결과를 바탕으로 2020년 4월과 2023년 3월에 소아 청소년에서의 적응증을 확대하여, 첫째, 18세에서 21세 사이의 청년층 중 중등도 내지 중증 OSA 환자(15≤AHI≤100), 둘째, 13세 이상 18세 이하의 다운증후군(Down syndrome) 환자 중 중증 OSA(10<AHI<50)를 포함하였다. 특히 이 연령대의 환자군은 다음 조건을 모두 충족해야 한다.7,8) 수면내시경에서 구개부 완전 원형폐쇄(CCC)가 없을 것, 편도절제술(adenotonsillectomy)에 금기이거나, 기존 수술로 효과가 없을 것, PAP 치료를 시행하였으나 순응 불가능하거나 효과가 없을 것, 표준 진료지침(standard of care)에 따라 가능한 모든 대체 · 보조 치료를 고려했을 것이며 이러한 기준을 충족하는 경우, 설하신경자극술은 해부학적 · 생리학적 조건이 명확히 규명된 맞춤형 치료로 시행될 수 있다.
Genio® system은 2019년 3월에 유럽 CE 인증을 획득한 후 미국 FDA에서 Genio® System 2.1에 대해 2025년 8월에 정식 승인을 받았다. 임상적응증으로는 중등도에서 중증의 폐쇄성수면무호흡증(15≤AHI≤65)에 대한 치료를 목적으로 승인된 양측 설하신경자극 장치로, 만 22세 이상의 성인에서 적용된다.4,9) 대상 환자는 생활습관 교정, 양압호흡기 치료(continuous 또는 bi-level positive airway pressure), 구강내 장치(예: 하악전진장치), 및 약물 치료(tirzepatide 등)와 같은 기존 표준 치료에 대해 치료 실패가 확인되었거나, 불내성 또는 적용 불가능한 경우로 한정된다.
Inspire® upper airway stimulation system의 금기증은 다음과 같다.2,7) 중추성 또는 혼합형 무호흡이 전체 무호흡-저호흡 사건의 25% 이상을 차지하는 경우, 상기도 자극 효과를 저해할 수 있는 해부학적 이상, 예를 들어 구개부 완전 원형폐쇄(CCC)가 존재하는 경우, 상기도 신경 조절 기능에 장애가 있는 경우 (예: 신경근 질환, 말초신경병증, 뇌간 손상 등), 수면 조정기(sleep remote)를 조작할 수 없거나 보조자가 없는 경우, 임신 중이거나 임신 계획이 있는 경우, MRI 비적합 모델을 이식한 경우(Inspire Model 3024은 MRI 촬영 금지, Inspire Model 3028: 제조사 지침[“MRI Guidelines for Inspire Implant”]에 따라 제한적 조건하에서 MRI 촬영 가능), 기타 전자이식기기(심박조율기, 신경자극기 등) 와 전기적 간섭 가능성이 있는 경우에는 이식 전 해당 제조사와의 상호작용 가능성을 반드시 확인해야 한다.
Genio® system 2.1의 금기증은 중앙형 또는 혼합형 무호흡이 전체 AHI의 25% 이상을 차지하는 경우, 장치의 삽입 · 활성화 · 지속 사용을 방해할 수 있는 해부학적 또는 의학적 상태, 상기도 신경조절 기능에 영향을 미치는 질환, 그리고 임신 또는 수유 중인 경우 등이 포함된다.4,9)
Inspire® upper airway stimulation system과 Genio® system은 모두 중앙형 또는 혼합형 무호흡이 전체 AHI의 25% 이상을 차지하는 경우를 공통적으로 금기증으로 규정하고 있다. 그러나 두 기기는 세부 금기 항목에서 차이를 보인다. Inspire는 환자가 기기 조작에 필수적인 외부 리모컨을 사용하지 못하거나 이에 대한 적절한 보조가 제공될 수 없는 경우를 명확한 금기 요소로 제시하며, 또한 기기와의 예기치 않은 상호작용이 우려되는 다른 삽입형 장치가 존재하는 경우, 또는 MRI 촬영 시 기기의 MR-조건을 충족하지 못하는 상황을 금기로 명시하고 있다.
Genio® system은 단일 삽입 모듈과 외부 활성화 칩을 활용하는 구조적 특성에 따라, 삽입 또는 활성화 과정, 혹은 지속적 사용을 방해할 수 있는 해부학적 · 기능적 이상이나 의학적 상태를 보다 포괄적인 금기 항목으로 포함하고 있으며, 상기도 신경조절 기능(neurological control)에 영향을 미치는 질환 또는 이전 시술력이 있을 경우 금기로 규정하고 있다는 점이 특징이다. 또한 Genio® System은 임신 및 수유 중 사용을 명확히 금기하는 반면, Inspire® upper airway stimulation system은 주로 기기 조작성, MRI 호환성, 그리고 삽입형 장치 간 상호작용 가능성에 보다 초점을 두고 있다. 이러한 차이는 두 기기의 기계적 설계와 작동 방식의 차이를 반영하며, 환자 선정 시 기기별 금기 조건을 면밀히 검토하는 것이 필요하다.
설하신경자극술 중에서 Inspire® upper airway stimula-tion system은 일측 설하신경의 내분지인 전방근 신경섬유를 선택적으로 자극하여 수면 중 상기도 붕괴를 방지하는 신경조절 기반 치료로, 2014년 미국 FDA 승인의 근거가 된 STAR trial 이후 다수의 전향적 연구와 장기 추적 결과가 축적되어 있다.1,10,11) 대표적인 STAR trial은 중등도–중증 OSA 환자 126명을 대상으로 한 다기관 전향적 일군 연구로, 12개월 시점에서 무호흡-저호흡지수(AHI)가 중앙값 68% 감소하였고, Sher 기준(≥50% AHI 감소 및 AHI<20) 수술 반응률(response rate)이 약 66%에 달했다.1) 주관적 졸림척도(epworth sleepiness scale, ESS) 및 기능적 수면관련 삶의 질(functional outcomes of sleep questionnaire, FOSQ)도 유의미하게 개선되었으며, 기기 관련 중대한 이상사례는 약 2% 정도로 매우 낮은 빈도로 보고되었다.
수술 후 5년 장기 추적한 일측 설하신경자극술을 시행한 폐쇄성수면무호흡증 환자의 다기관 전향적 코호트 연구 결과에서도 AHI 반응률(AHI <20/h 및 ≥50% 감소)은 5년 시점에서 75%였으며, 최종 관찰치 대입 분석을 적용할 경우 63%로 유지되었다.10) 또한 주간 졸림(ESS)과 삶의 질 지표는 각각 정상 범위로의 회복 비율이 33%에서 78%, 15%에서 67%로 증가하였다. 심각한 기기 관련 이상반응은 전체 환자의 6%에서 발생하였고 대부분 리드 또는 기기 조정과 연관된 사건이었다.
다기관 전향적 관찰연구인 ADHERE registry는 지속적양압호흡기 치료에 실패한 폐쇄성수면무호흡증 환자를 대상으로 설하신경자극술의 실제 효과를 평가하였다.11) 이 연구에서는 2016년부터 2019년까지 총 1,017명이 등록자 중에서 640명은 6개월, 382명은 12개월 추적을 완료하였다. 12개월 시점에서 AHI 중앙값은 32.8에서 9.5로 유의하게 감소하였으며(평균 35.8→14.2, p<0.0001), Epworth 졸림척도 또한 11.0에서 7.0으로 개선되었다(p<0.0001). 치료 사용 시간은 1일당 평균 5.6±2.1시간으로 높은 순응도를 보였다. 다변량 분석에서 여성 성별과 낮은 기저 체질량지수가 독립적 치료 반응 예측 인자로 확인되었다. 이러한 결과는 실제 임상 환경에서도 설하신경자극술이 객관적 호흡지표와 증상 개선에 효과적이며 높은 순응도를 보이는 치료 전략임을 보여준다.
Inspire® upper airway stimulation system은 수술 후 합병증은 주로 경증의 절개부 통증, 설근 움직임의 일시적 불편감 등이 대부분이며, 장기간 따른 기기 문제는 리드 단선 또는 IPG 교체 필요성과 같은 일부 기계적 이슈가 보고되나 발생률은 낮다. 대부분의 이상반응은 경미한 것으로 알려져 있다.1,10,11)
Genio® system은 양측(bilateral) 설하신경자극 기반의 리드리스(lead-less) 장치로 개발된 신경조절 치료로, CE 인증 이후 BLAST-OSA 연구 등 주요 전향적 임상시험을 통해 그 안전성과 유효성이 검증되었다.12,13)
BLAST-OSA 연구는 호주 · 프랑스 · 영국 등 8개 기관에서 시행된 다기관 · 전향적 · 단일군 임상시험으로, 양압기치료 불내성 중등도–중증 OSA 환자 27명을 대상으로 6개월 추적 결과를 보고하였다.12) 이식 환자 중 22명이 추적을 완료하였으며, AHI는 23.7±12.2에서 12.9±10.1 events/h로 유의하게 감소하였고, ODI 역시 유의미하게 개선되었다. 주간 졸림과 수면 관련 삶의 질 지표는 모두 개선되었으며, 참여자의 91%가 주 5일 이상, 77%가 하루 5시간 이상 기기를 사용하였다. 6개월 동안 기기 관련 중대한 이상반응은 보고되지 않아, 기존 단측 설하신경자극술과 유사한 효과를 보다 단순화된 시스템으로 달성할 수 있음을 확인하였다.
양측 설하신경자극술에 대한 다기관 핵심 임상시험에서는 양압치료를 거부하거나 실패 · 불내성인 중등도–중증 폐쇄성수면무호흡증 성인을 대상으로 113례에서 장치를 이식하고 12개월간 추적한 결과를 보고하였다.13) 12개월 시점에서 AHI 반응률은 63.5%, ODI 반응률은 71.3%로 유의한 개선을 보였고, 평균 AHI는 18.3 events/h, ODI는 17.7 events/h 감소하였다(p<0.001). 산소포화도 <90% 수면비율도 유의하게 감소하고 ESS, FOSQ 등 주관적 지표 역시 모두 개선되었다. 중대한 이상사례는 10명(8.7%)로 수용 가능한 수준이었다. 이러한 결과는 양측 설하신경자극술이 OSA 중증도와 삶의 질을 전반적으로 향상시키는 유효한 치료 방법임을 보여주며, 향후 기존 단측 설하신경자극술을 보완할 잠재적 대안이 될 수있다고 제시하였다.
결론
설하신경자극술(hypoglossal nerve stimulation)은 양압기 치료에 실패하거나 순응하지 못하는 중등도–중증 폐쇄성수면무호흡증 환자에서 유효성과 안전성이 검증된 생리학적 치료 옵션으로 자리매김하고 있다. Inspire® upper airway stimulation system을 중심으로 축적된 다수의 임상 근거는 장기 추적에서도 지속적인 무호흡지수 감소, 산소탈포지수 개선, 주간 졸림 완화, 높은 환자 만족도 등을 일관되게 제시하고 있으며, 최근 Genio® system과 같은 양측 · 무전극 기반의 신형 플랫폼은 술기 부담을 감소시키고 적용 범위를 확장할 가능성을 보여주고 있다.
설하신경자극술 치료의 결과는 무엇보다 정확한 환자 선택과 표준화된 수술 술기에 의해 좌우된다. 완전 동심성 구개 허탈(complete concentric collapse)의 배제, BMI 기준, 해부학적 기도 평가 등 적응증 준수는 치료 반응률을 결정하는 핵심 요소이며, 자극리드 · 감지리드의 정확한 배치, IPG 포켓 형성 및 리드 고정 등 술기적 완성도 역시 장기 성적에 중요한 영향을 미친다. 수술 후 초기 치유 기간을 고려한 자극 활성화 시점 설정, 프로그래밍 최적화, 추적관찰을 통한 자극값 조절 등 체계적인 관리 과정 또한 필수적이다.
현재까지 확보된 근거는 설하신경자극술이 폐쇄성수면무호흡환자에서 양압기 치료에 대한 대안 치료로서 임상적 유용성이 크고, 장기적인 치료 지속 가능성이 높은 기기 기반 치료임을 보여주고 있다. 향후 축적되는 임상 경험과 세부 술기 표준화는 치료 적응증을 더욱 정교화하고, 향후 국내에서도 설하신경자극술의 역할을 확대하는 데 기여할 것으로 전망된다.
