서론
외이도 진주종(external auditory canal cholesteatoma, EACC)은 1982년 Anthony에 의해 처음 체계적으로 기술된 이후,1) 그 임상적 특성과 치료법에 대한 이해가 꾸준히 발전해왔다. EACC의 정확한 유병률은 명확하지 않으나, 중이 진주종의 약 1/30–1/60 정도로 보고되며,2) 유럽에서는 연간 백만명당 약 1.5–3례로 보고된 연구가 있다.3) 성별 분포는 남녀 비 1:1.75로 여성에서 더 높은 발생률을 보이며, 연령 분포는 7세부터 81세까지 다양하나 중앙값은 34.5세이다. 발생 위치는 우측 외이도에서 더 흔하게 관찰되어 우:좌측 비율이 1.6:1을 보인다.4–6) 이러한 성별, 연령, 좌우 차이의 원인은 아직 명확히 밝혀지지 않았으나, 최근 연구에서는 고령, 여성 성별, 좌측 외이도 질환, 골다공증, 신장 기능 장애, 빈혈, 비스포스포네이트 치료 등이 EACC 발생의 위험인자로 제시되고 있다.7) 본 질환은 중이 진주종과는 구별되는 독특한 병태생리와 임상 양상을 보인다. 또한, 낮은 발생률과 높은 자연 회복률로 인해 지금까지 큰 관심을 받지 못했으나, 장기간 추적관찰 시 높은 재발률과 중이염으로의 이행 등의 문제점이 관찰되어 최근에는 조기 진단과 치료의 중요성이 강조되고 있다.6,8)
따라서 적절한 치료를 위해서는 정확한 진단과 병기 설정이 필수적이다.5,8)
본 종설은 EACC의 병태생리, 임상 증상, 영상 및 조직학적 진단 방법, 주요 병기 분류 체계, 그리고 병기별 치료 전략 및 예후에 대하여 최신 문헌을 바탕으로 정리하였다. 이를 통해 임상의들이 보다 체계적이고 개인화된 EACC에 대한 치료 전략을 수립하는 데 도움이 되고자 한다.
본론
EACC의 발생 기전은 아직 명확히 밝혀지지 않았으며, 다양한 병인론적 가설이 제시되고 있다. 가장 유력한 것은 외이도 상피 이동 장애설(Impaired epithelial migration)이다. 정상적으로 외이도 피부의 각질은 밖으로 배출되지만 어떤 원인으로 이 이동이 방해받아 케라틴 축적물이 형성된다는 이론이다.9) 하지만 최근 연구에서는 정상 귀와 EACC 병변 귀 간에 상피 이동률의 유의한 차이가 없음을 보고하였으며, 이에 따라 해당 가설에 대한 논쟁이 지속되고 있다.10) 또 다른 가설로는 만성염증 및 골막염(Local inflammation and periostitis)에 의한 발생 기전이 제시된다. 만성적인 외이도염 등의 염증으로 골막에 염증반응이 일어나면 골흡수가 촉진되고, 이로 인해 생긴 골결손 부위에 각질이 침착되어 진주종이 형성된다는 이론이다.11) 이 밖에도 외이도 피부의 외상 또는 수술 후 이상 치유로 인한 흉터 형성, 방사선 치료 후 발생한 협착 등이 이차성 EACC의 원인이 될 수 있으며, 일차성(특발성)인 경우에도 미세한 외상이나 감염이 계기가 되었을 가능성이 있다.12) EACC가 골파괴를 일으키는 기전은 중이 진주종과 유사하게 압력 괴사(pressure necrosis)와 골흡수가 주요 원인으로 분석된다.13) 축적된 케라틴이 국소적인 압력을 가해 뼈를 얇게 만들고, 동시에 만성염증으로 분비된 TNF-α, IL-1, IL-6 등의 사이토카인들이 골흡수를 촉진하여 주위 뼈조직을 파괴한다.14) 최근 연구에서는 S100A8 및 S100A9와 같은 염증 관련 단백질은 사이토카인 자극 및 파골세포의 활성화를 유도하여, EACC에서의 골파괴 기전에 중요한 역할을 하는 것으로 밝혀졌다.15)
EACC의 주요 증상은 비교적 경미하고 비특이적 이어서 초기에는 큰 불편을 느끼지 못하는 경우가 많다. 가장 흔히 보고되는 증상은 청력저하나 이폐색감(86%), 이통(75%), 이루(41%) 순이다.9,10) 이명은 약 18%에서 동반되는데, 이는 병변이 고막이나 이소골 연쇄에 영향을 미치는 경우 발생하는 것으로 생각된다.10) 일부 환자에서는 어지럼증과 안면마비를 호소하기도 하는데, 이는 내이와 가까운 부위의 골파괴와 연관될 수 있으며 매우 드물게 나타난다.16)
신체 검진에서는 이경 검사 소견상 외이도 골부에 국소적인 함몰이나 골 결손이 확인되며, 그 안에 백색의 케라틴 침착물이 있는 모습이 관찰될 수 있다.9) 병변이 진행되면 외이도 후벽이나 하벽의 골결손이 두드러지게 나타나며, 그 결손 부위에 각질성 물질이 덮혀 있는 것을 확인할 수 있다. 고막은 일반적으로 정상이거나 온전하게 보존되어 있는 경우가 많아, 중이에서 기원한 진주종과 감별에 중요한 단서가 된다.3,9,10) 골벽 침식의 분포에 관한 연구에 따르면,6,17) 후벽과 하벽이 가장 높은 빈도로 침범되며, 그다음으로 전벽, 상벽 순으로 나타난다. 또한 단일 골벽 침범보다 다발성 골벽 침범이 더 높은 빈도를 보이며, 전체 환자의 약 84%에서 두 개 이상의 골벽이 동시에 침범된 것으로 보고되었다. 특히 젊은 연령대, 남성, 후벽 침범, 이루(otorrhea) 동반 시에 진행기(advanced) EACC로의 발전 위험성이 증가하므로 보다 적극적인 치료적 접근이 권장된다.7,18)
앞서 기술한 임상 증상과 이경 검사 소견은 EACC를 의심하는 중요한 단서가 된다. 최근에는 외이도 내시경이 임상적으로 널리 활용되므로 이를 활용한 외이도 소견 확인은 필수적이다. 특히 외이도 골부의 국한된 함몰과 케라틴 침착물의 존재, 그리고 고막이 정상적으로 유지되는 소견은 EACC의 특징적인 소견이다.9)
컴퓨터 단층촬영(computed tomography, CT)은 EACC 진단과 평가에 있어 가장 중요한 검사로, 고해상도 측두골 CT를 통해 외이도 내 연조직 및 미만성 골파괴 소견을 명확히 확인할 수 있다(Fig. 1 and 2).10,11,19) 전형적인 CT 소견은 외이도 골부를 채우는 연조직 음영과 인접한 뼈의 미란(erosion)이다. 또한 병변 내에 분리골편(sequestra)이 관찰되는 경우도 흔하며, CT에서 작은 부유 골조각이 보일 경우 EACC를 시사하는 소견으로 간주된다.11) 병변은 주로 외이도의 후벽 및 하벽(posterior and inferior walls)에서 호발하며, CT소견상 후하벽의 함몰 혹은 결손이 흔하게 나타난다.6,17) CT 검사는 병변의 범위와 병기 결정에 필수적이다. 이를 통해 병변이 단순히 외이도에 국한된 것인지, 고막을 침범하여 중이강으로 확장되었는지, 유양동을 침범하였는지, 안면신경관이나 고실천장부, 횡정맥동 등에 근접해 있는지를 평가할 수 있다.
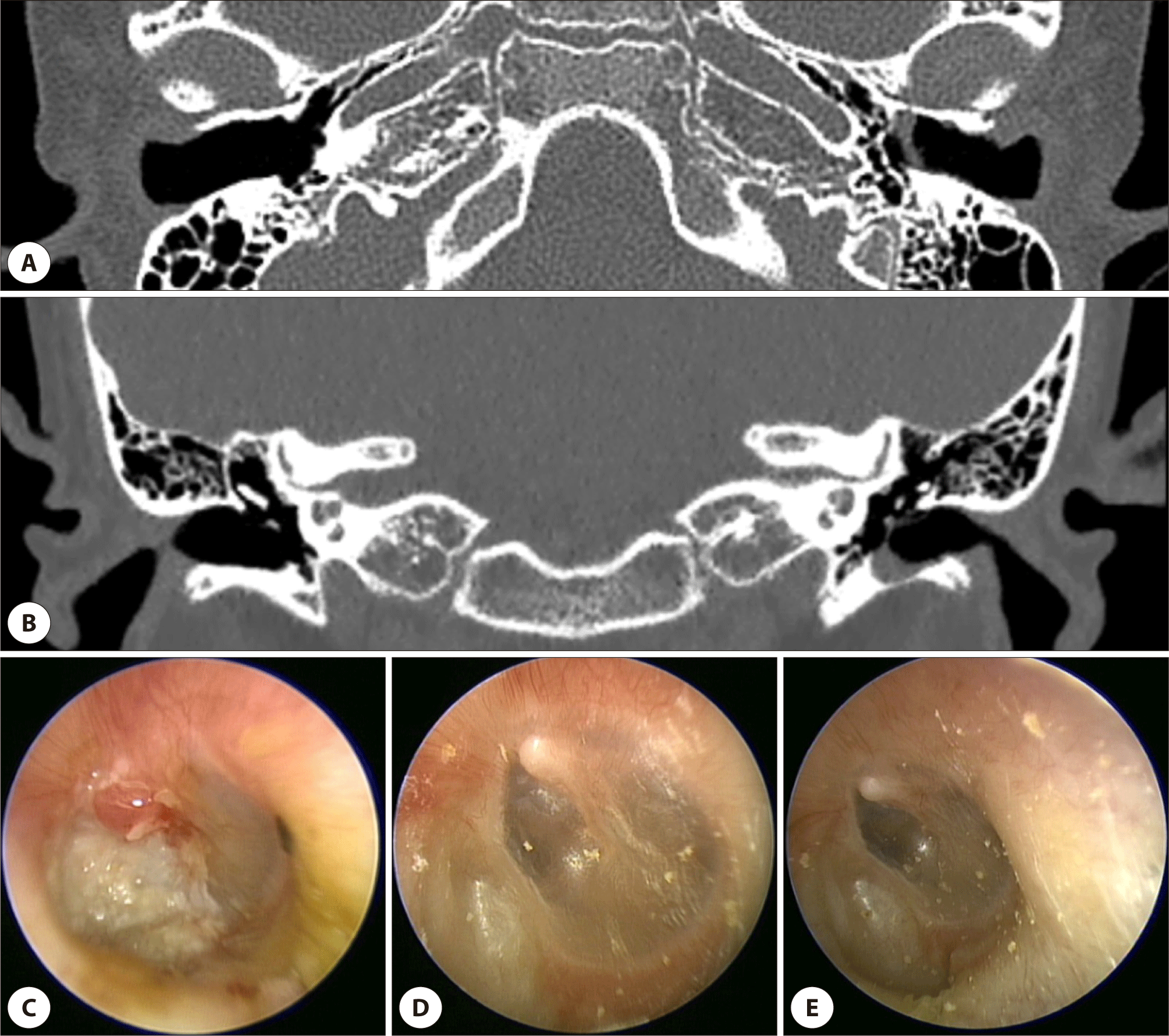
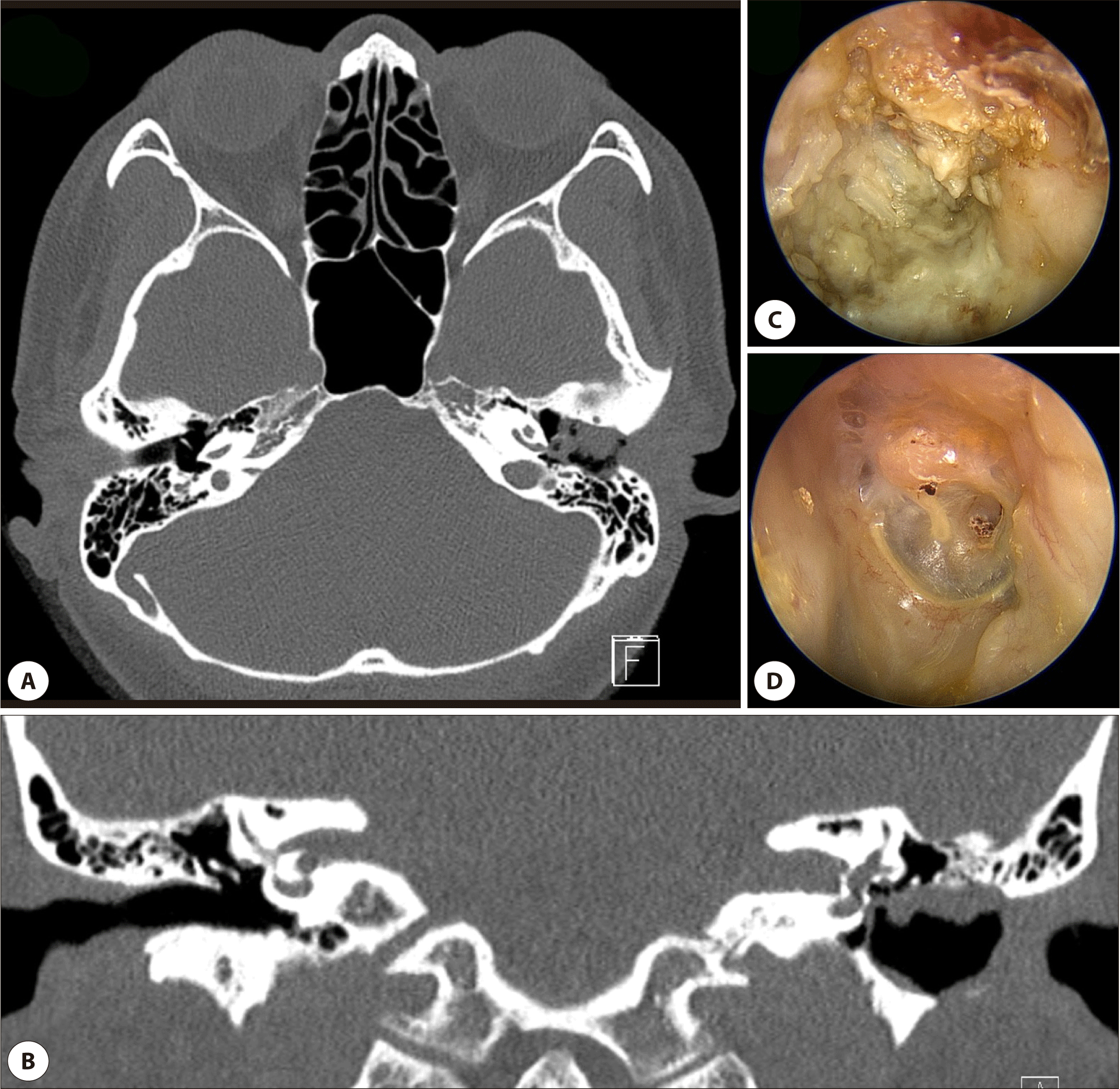
자기공명영상(magnetic resonance imaging, MRI)은 연조직의 평가에 유용하지만, EACC의 경우 뼈의 미세 파괴가 주요 소견이므로 일차적인 진단 검사로는 권장되지 않는다. 다만, 확산강조영상(diffusion-weighted imaging, DWI)은 콜레스테롤과 각질로 이루어진 진주종의 특성상 제한 확산(restricted diffusion) 신호를 보이므로, 병변이 중이 또는 두개내로 확장된 경우 연조직 경계를 파악하는 데 도움이 될 수 있다.20)
전형적인 임상 및 영상 소견이 있는 경우 EACC의 진단은 비교적 용이하지만, 감별진단이 필요한 경우나 악성을 시사하는 병변의 확진을 위해 조직 검사를 시행하기도 한다. EACC의 조직병리학적 특징은 과각화된 편평상피로 이루어진 낭성 구조와 내부의 케라틴 축적물이다.21) 이러한 소견은 중이 진주종과 유사하며, 특히 악성 종양과의 감별에 중요하다. 예를 들어, 분화도가 높은 편평세포암(squamous cell carcinoma)은 진주종과 유사한 각질 진주(keratin pearl)를 형성할 수 있으나, 침습적인 암세포 증식 및 세포 이형성(atypia)이 동반되므로 조직학적 평가를 통해 명확히 구별할 수 있다.22) 또한 만성 육아종성 염증에 의한 골 파괴와 육아조직 형성도 EACC와 유사한 소견을 보일 수 있으므로, 조직검사에서 육아종성 변화나 특이 염증소체(예: 결핵성 육아종, 진균구 등)가 확인될 경우 다른 진단을 고려해야 한다.23,24)
EACC의 감별진단으로는 폐쇄성 각화증(keratosis obturans)이 있다. 이 질환은 외이도 내 각질덩어리 축적으로 인해 겉보기에는 EACC와 유사할 수 있으나, 일반적으로 양측성으로 발생하고 외이도 전체의 확장을 유발하며, 골파괴가 거의 동반되지 않는다는 점에서 차이를 보인다. 또한 폐쇄성 각화증은 극심한 이통 및 심한 전음성 난청을 유발하지만, EACC는 통증이 비교적 경미하고 청력 소실 역시 진행된 경우를 제외하면 경미한 경우가 많다.25)
괴사성 외이도염(necrotizing otitis externa) 또는 악성 외이도염(malignant otitis externa)은 주로 당뇨 및 면역저하 상태에서 발생하는 외이도 골파괴성 감염으로, 심한 이통과 이루는 EACC와 공통적이나 원인균(Pseudomonas 등)에 의한 감염 증거와 전신 증상이 동반된다는 점에서 차이가 있다.26)
외이도 악성 종양(external auditory canal [EAC] cancer) 역시 만성 이루 및 골파괴를 유발할 수 있으며, 국소 소견상 종양이 의심되거나 병변의 경계가 불규칙하고 출혈 경향이 있는 경우 조직검사를 통한 감별진단이 필수적이다.27)
EACC는 침범 범위에 따라 임상 양상이 달라지고 치료 방침과 예후가 크게 좌우되므로 여러 가지 병기 분류 체계가 제안되어 왔다. 주요 병기 분류 체계는 다음과 같다(Table 1).
| Stage | Holt Classification (1992)28) | Naim Classification (2005)21) | Shin Classification (2010)4) | He Classification (2019)29) |
|---|---|---|---|---|
| I | Superficial, localized shallow concave defect or local pit in bony portion of EAC | Hyperplasia and hyperemia of the EAC epithelium | Lesion limited to the EAC | Invasion without bony lesions confined to EAC only |
| II | Localized deep EAC pocket formation | Local inflammation and periostitis (without bone destruction) | Invasion of tympanic membrane and middle ear (EAC+middle ear) | Confined within EAC with bone erosion or localized bone defect |
| III | Extension into the mastoid | EAC bone destruction with sequestrum | Invasion of mastoid air cells (EAC+mastoid) |
Invasion beyond EAC but confined within temporal bone: • IIIA: Middle ear cavity invasion • IIIB: Mastoid air cell invasion • IIIC: Both middle ear cavity and mastoid invasion |
| IV | - | Spontaneous destruction of adjacent anatomical structures | Extension beyond temporal bone | Invasion beyond temporal bone |
1992년 Holt가 처음 제안한 분류는 병변의 깊이와 범위에 따라 단순히 3단계로 구분하는 방식이었다.28) 이 분류법은 단순명료하여 이해하기 쉽다는 장점이 있었으나, 측두골을 넘어선 진행성 병변을 포함하지 않는 한계가 있었다.23)
2005년 Naim은 병리학적 소견에 기반한 새로운 분류체계를 제안했다.21) 이 분류는 질환의 발생 및 진행 과정을 세부적으로 이해하는 데 기여하였으며, 특히 임상적 증상이 나타나기 전 초기 병변을 포함함으로써 조기 진단의 중요성을 강조하였다. 그러나 수술 중 채취한 조직의 특성에 따라 II기와 III기의 구분이 모호해질 수 있다는 실용적 한계가 지적되었다.21,23)
2010년 Shin의 분류는 임상 현장에서의 활용도를 높이고 치료 계획 수립에 실질적 도움이 되도록 기존 분류 체계를 발전시켰다.4) 특히 IV기를 추가하여 측두골 경계를 넘어 확장된 경우까지 고려한 점은 중요한 진전으로 평가된다. 다만 이 분류에서는 II기(고막 및 중이 침범)와 III기(유양동 침범)의 구분이 질환의 진행 단계를 반영하기보다는 단순히 침범 방향의 차이에 기반하고 있다는 한계가 지적되었다.4,6)
가장 최근인 2019년, He가 제안한 분류는 이전 분류들의 한계점을 보완한 보다 종합적인 체계로 평가된다.29) 특히 III기를 세 가지 아형으로 세분화하여 수술적 접근법 선택에 실질적인 지침을 제공하고 있으며, 2024년 발표된 최신 연구에서는 각 단계별 예후 예측 및 적절한 치료 방법 선택에 관한 결과도 보고되어, 치료 방법 부분에서 이를 함께 제시하고자 한다.6)
각 분류 체계는 제안된 배경과 중점이 상이한 부분이 있어 직접적인 일대일 비교는 어렵지만, 공통적으로 병변의 국한(I기), 국소 진행(II기), 인접 구조 침범(III기), 원거리 확산(IV기)의 순으로 중증도가 증가한다는 개념을 기반으로 한다. 이러한 분류 체계의 발전은 EACC환자들에게 보다 정확한 진단과 개인화된 치료 계획을 수립하는 데 중요한 역할을 할 것으로 기대된다.
수술적 제거는 EACC 치료의 근간이 되는 방법이다. 진주종은 한 번 형성되면 자연 소실되지 않고 지속적으로 각질이 축적되어 주변 골조직을 파괴하므로, 병변을 가능한 한 완전히 제거하고 외이도 공간을 재건하는 것이 치료의 원칙이다.30) 수술의 적응증은 여러 연구에서 보고되어 있으며, 병변의 진행 정도와 골파괴 범위가 가장 중요한 판단 기준이다.12,31) 그 외에도 지속적인 이루, 이통, 전음성 난청 등 증상의 명확한 발현이나, 감별 진단을 위한 조직검사가 필요한 경우에 수술이 고려된다.6,30)
병변이 국한된 초기 EACC는 비교적 소규모의 수술로 치료가 가능하다. 국소 마취 하에 외이도 경유로 접근하여 병변을 제거하는 경외이도 진주종 제거술(transcanal cholesteatoma removal, TCR)이 1차적인 치료로 시행되며,5) 이때 외이도 성형술(canaloplasty)을 병행하는 것이 재발률을 낮추는 데 중요하다.5,27) 외이도 성형술은 드릴을 이용하여 외이도의 협착 부위 및 불규칙한 골면을 확장 및 평탄화하는 술식으로, 진주종이 형성되었던 함요(recess)를 제거하여 재발성 각질 포켓의 형성을 방지한다.8,27) 특히 Stage II 병변에서 외이도 골결손 주위에 잔존하는 골성 융기(bony prominence)는 각질이 다시 축적되기 쉬운 부위로, 이를 제거하여 외이도 벽을 평탄화하는 것이 중요하다.5) 얕은 함몰을 동반한 Stage I 혹은 골미란만 동반된 Stage II 병변 상당수는 내시경 또는 현미경을 이용한 TCR만으로 완치될 수 있으며, 수술 후 90% 이상에서 재발 없이 치유되는 것으로 보고된다.5,27) 이러한 재발률 감소를 위해 병변 제거 이후의 외이도 재건이 매우 중요하다. 특히 canaloplasty 이후에는 이주연골(tragal cartilage) 혹은 이개강연골(conchal cartilage) 이식을 통해 외이도의 구조적 지지를 보강하며, 피부 결손이 있는 경우에는 후이개(post-auricular) 부위에서 채취한 부분층 피부 이식편(split-thickness skin graft, STSG)을 적용할 수 있다. 일반적으로 5×10 mm 크기의 STSG는 외이도 재건에 적합하며 수술 후 재 협착 없이 좋은 예후를 보인다는 보고가 있다.32)
병변이 외이도를 넘어 중이강이나 유양돌기 일부까지 확장된 경우, 보다 넓은 수술적 접근이 필요하며 일반적으로 후이개 절개를 통해 수술현미경하 접근이 이루어진다.5,16)
Stage IIIA(중이강 침범)의 경우, 고실성형술(tympanoplasty)을 통해 중이내 병변을 제거하고, 손상된 고막을 복원한다. 이소골의 파괴가 동반되었거나 청력 개선이 필요한 경우, 1차 수술에서 이소골 재건술(ossiculoplasty)을 시행할 수 있다. 단, 염증이 심한 경우에는 1차 수술로 진주종 제거 및 감염 조직의 정리를 우선 시행하고, 6개월에서 1년 후 병변이 안정된 시점에 2차적으로 청각 재건술을 고려한다.6,17)
Stage IIIB(유양동 침범)의 경우 유양돌기절제술(mastoidectomy)이 요구된다. 병변이 있는 유양돌기 부위를 드릴로 개방하여 진주종 및 염증 조직을 완전히 제거하고, 외이도와 유양동 사이의 경계를 확장하는 것이 핵심이다. 이를 통해 잔존 진주종이 남을 수 있는 모든 공간을 시야에 포함시키고, 외이도와 유양동을 하나의 공동(cavity)으로 연결함으로써 재발 가능성을 줄일 수 있다.5,6,17)
Stage IIIC(중이강과 유양동 모두 침범)는 가장 복잡한 양상의 병기로, 유양돌기절제술, 외이도 성형술, 고실성형술 등의 복합적인 수술적 처치가 필요하다.6) 이 단계에서는 병변이 안면신경관까지 침범할 수 있으므로, 수술 중 안면신경의 위치를 주의 깊게 확인하는 것이 중요하다.
병변이 측두골을 넘어 인접 구조물로 파급되었거나 중증 합병증이 동반된 경우에는 표준화된 치료법을 제시하기 어렵다.2) 개별 환자의 전신 상태와 병변의 침범 범위에 따라 맞춤형 수술 전략이 필요하며, 경우에 따라 신경외과와 협력하여 두개내 접근을 병행하거나 확장 절제술(extended resection)을 시행해야 한다. 또한 심각한 두개내 합병증이 동반된 경우에는 감염 조절을 위해 적절한 배농과 항생제 치료를 병행하는 것이 필수적이다.16,30)
수술적 치료는 위에서 언급되었듯이 Stage에 따라 다양한 접근 방법을 택할 수 있다. 치료 방법을 종합적으로 비교·이해할 수 있도록 주요 문헌들의 내용을 다시 표로 정리하였다(Table 2).
모든 EACC 환자에서 반드시 수술이 필요한 것은 아니다. 고령이거나 내과적 고위험 환자 등 수술적 치료가 곤란한 경우, 또는 병변 범위가 매우 제한적인 초기 단계(Stage I–II)에서는 보존적 치료를 고려할 수 있다.16,33) 보존적 치료의 핵심은 정기적인 드레싱과 국소 치료로, 주기적으로 환자를 내원시켜 현미경 또는 내시경 하에 외이도 내 축적된 케라틴을 제거하고, 필요 시 국소 스테로이드제나 항생제 연고를 도포하여 염증을 조절한다. 이를 통해 병변의 진행을 억제하고 증상을 완화할 수 있다.33) 보존적 치료의 성공 여부는 환자의 순응도와 정기적인 추적 관찰 가능성에 크게 의존한다. 만약 드레싱과 국소 치료에도 불구하고 병변이 진행하거나, 심한 통증, 청력 저하, 현기증 등의 증상이 악화될 경우에는 수술적 치료로의 전환이 필요하다.9)
EACC의 예후는 병변의 범위(병기)와 치료 방식에 크게 좌우된다. 병기별 치료 성공률 및 재발률을 살펴보면, 일반적으로 Stage I–II의 국한된 병변은 적절한 수술적 처치 시 90% 이상에서 완치가 가능하다. 반면 Stage III, 특히 IIIC(중이강과 유양동 모두 침범)의 경우 재발률이 30–40%까지 증가할 수 있으며, IV기는 치료 방법에 따라 예후가 다양하지만 대체로 불량한 것으로 보고된다.6,7)
EACC 치료 후 발생 가능한 주요 합병증은 시기에 따라 구분할 수 있다. 조기 합병증(수술 직후)으로는 외이도 협착(31%), 고막 천공(24%), 이차 감염(18%)이 흔하며, 드물게 안면신경 마비(3%)가 보고된다. 후기 합병증(치료 후 수개월–수년 경과)으로는 진주종 재발(15–25%), 난치성 이루(12%), 청력 저하(8%) 등이 대표적이며, 드물게 지연성 두개내 합병증이 발생하기도 한다.29)
재발의 주요 위험 인자로는 불완전한 병변 제거, 외이도 성형술의 미흡, 다발성 골벽 침범, 고령, 면역저하 상태 등이 제시된다. 특히 외이도 골벽 이행부(외이도와 유양동 경계 부위)를 평활화하지 못한 경우 케라틴이 잔존으로 인한 재발 위험이 높아지므로, 수술 중 건전 골조직이 노출될 때까지 완전 제거가 필요하다.5,7,26)
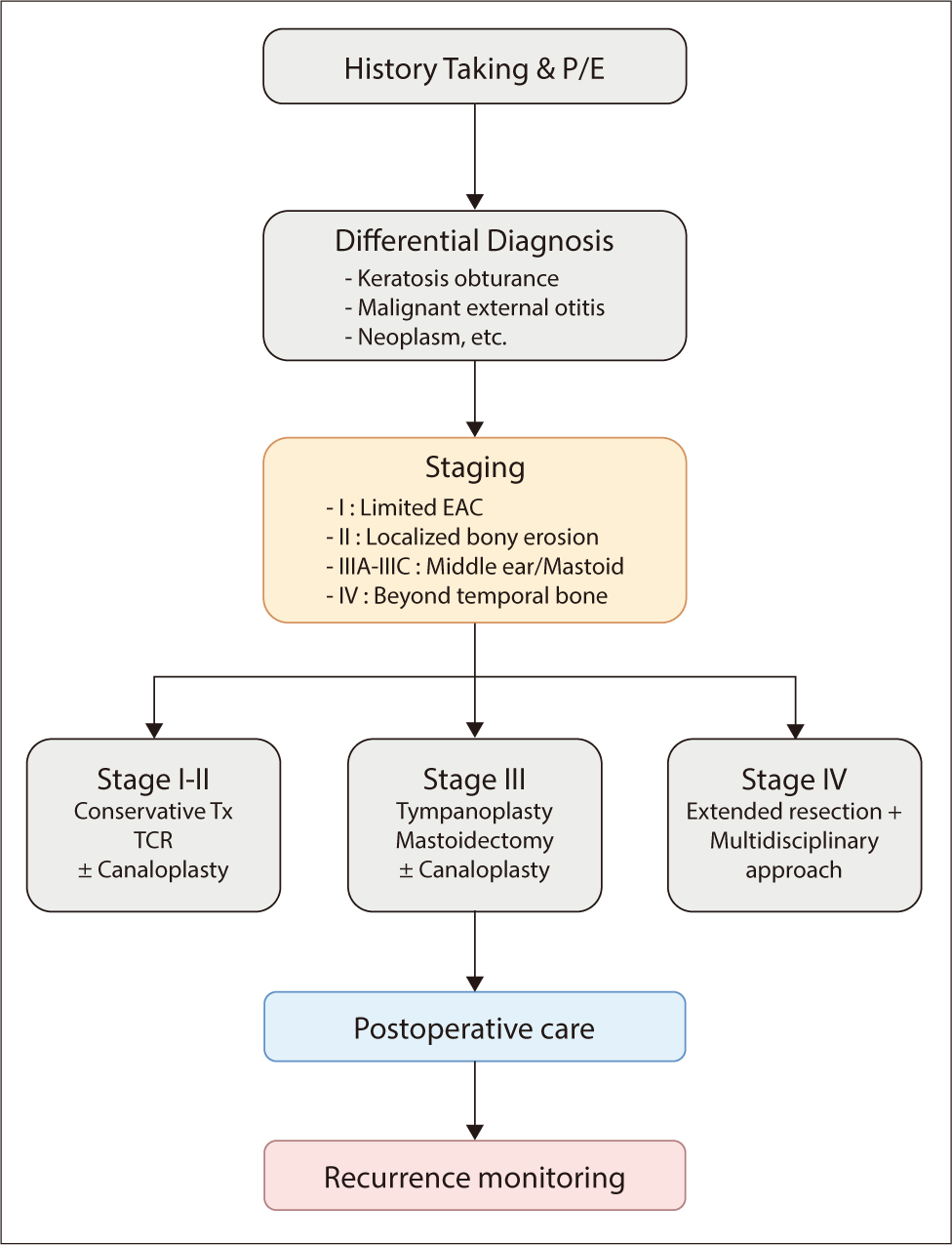
장기 예후에 영향을 미치는 주요 요소로는 진단 당시의 병기, 치료 방법의 적절성, 수술 후 정기적 추적관찰 여부가 있다. 조기에 진단되어 병기에 맞는 적절한 치료가 시행된 경우 대부분 양호한 예후를 보이지만, 진단이 지연되거나 치료가 불완전한 경우 반복적인 재발과 합병증으로 장기 이환이 초래될 수 있다.6,7,29) 따라서 조기 발견과 병기별 적절한 치료 전략 수립이 예후 개선의 핵심이라 할 수 있다(Fig. 3).
EACC는 다양한 상황에서 발생하나, 특히 비인두암에 대한 방사선 치료 후 이차성으로 발생 위험이 현저히 증가한다. 2023년 연구에 따르면,34) 방사선 치료를 받은 환자에서 EACC 발생 위험은 일반 인구 대비 약 18배 상승하며, 평균 6.5년(범위 0.5–15.4년) 후 진단된다. 발생기전으로는 방사선에 의한 정상 상피 이동 경로의 손상, 혈관 손상에 따른 국소 허혈 및 골괴사가 진주종 형성을 촉진하는 것으로 추정된다. 방사선 유발 EACC는 일반적 EACC보다 진행 속도가 빠른 경향을 보이므로, 정기적인 추적 관찰과 조기 진단이 필수적이다.
드물게 골섬유 이형성증과 동반된 EACC가 보고되었는데, 이 경우 이상 골형성으로 인한 외이도 변형이 진주종 발생의 소인으로 작용할 수 있다. 이러한 환자에서는 외이도의 구조적 변형이 더 심하게 나타나며, 수술적 치료 시 비정상적인 골조직으로 인해 술기가 더욱 복잡해질 수 있다.35)
소아 EACC는 성인과는 다른 임상적 특성을 보인다. 소아에서는 질병의 진행속도가 상대적으로 빠르고, 보다 광범위한 골파괴를 동반하는 경향이 있어 적극적인 치료가 요구된다.36) 또한, 소아 EACC의 약 36%가 진단 시 이미 Stage III이상의 진행된 병기를 보이는 것으로 보고되었다.29) 이러한 특성으로 인해 소아 환자에서는 전신마취 하 완전 제거술이 권장된다. 아울러, 소아는 병변에 대한 자가 인지 능력이 부족하고 증상 표현이 불명확할 수 있어 진단이 지연될 가능성이 높으므로, 정기적인 이비인후과 검진이 필수적이다.
결론
EACC는 비교적 드물지만 골파괴성 특성을 지닌 임상적으로 중요한 질환이다. 국소소견 및 고해상도 측두골 CT 소견(외이도 골부 함몰 및 케라틴 침착물)이 진단의 핵심이다. 치료는 병기에 따라 개별화되어야 하며, 초기 병변(Stage I–II)에서는 경외이도 접근을 통한 병변 제거와 외이도 성형술이, 진행된 병변(Stage III–IV)에서는 후이개 접근을 통한 유양돌기절제술 또는 확장 접근이 요구된다. 특히 외이도와 유양동 경계부의 완전한 평탄화는 재발 방지에 결정적이다. 방사선 치료 후 발생한 EACC 및 소아 EACC는 질환의 진행 속도가 빠르고 골파괴가 광범위하여 보다 적극적인 수술적 접근과 엄격한 추적 관찰이 필요하다. 조기 진단과 적절한 수술적 개입은 예후를 결정하는 주요 인자로, 치료 후 정기적인 추적 관찰을 통한 재발 조기 발견 및 대응이 매우 중요하다.
