종설
코로나바이러스감염증-19 환자의 구강증상과 병리학적 기전
박기철
1,*
Pathological Mechanisms of Oral Manifestations in Patients with COVID-19
Gi Cheol Park
1,*
1성균관대학교 의과대학 삼성창원병원 이비인후과학교실
1Department of Otorhinolaryngology - Head and Neck Surgery, Samsung Changwon Hospital, Sungkyunkwan University School of Medicine, Changwon, Korea
*Corresponding author: Gi Cheol Park, Department of Otolaryngology, Samsung Changwon Hospital, 158, Paryong-ro, MasanHoewon-gu, Changwon 51353, Korea, Tel: +82-55-233-5983 · Fax: +82-55-233-5441 · E-mail:
uuhent@gmail.com
© Copyright 2021 The Busan, Ulsan, Gyeoungnam Branch of Korean Society of Otolaryngology-Head and Neck Surgery. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Aug 31, 2021; Revised: Oct 05, 2021; Accepted: Nov 07, 2021
Published Online: Dec 31, 2021
ABSTRACT
Coronavirus disease 2019 (COVID-19), caused by the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection, is rapidly spreading worldwide. Oral manifestations of COVID-19, including sore throat, loss of taste, dry mouth, and ulceration have been widely reported. SARS-CoV-2 enters host cells using angiotensin-converting enzyme 2 (ACE2) and transmembrane protease serine 2 (TMPRSS2). Therefore, high levels of expression of ACE2 and TMPRSS2 may enhance SARS-CoV-2 invasion. ACE2 and TMPRSS2 were expressed in the taste bud and intermediate layer of the squamous epithelia of tongue papillae. Additionally, ACE2 and TMPRSS2 were co-expressed in the ductal epithelium and acinar cells of salivary glands and in the neuronal cell body of trigeminal ganglia. SARS-CoV-2 directly invades the oral taste buds, causing loss of taste. Additionally, the possibility of neuroinvasion innervation of taste bud cells cannot be excluded. SARS-CoV-2 spreads around the suprabasal areas of the oral squamous epithelia, and invades the trigeminal nerve, resulting in oral manifestations. SARS-CoV-2 can directly invade the parotid and submandibular glands, as well as minor salivary glands, through the duct orifice. This may lead to sialadenitis and salivary contamination. (J Clinical Otolaryngol 2021;32:163-169)
Keywords: COVID-19; Oral manifestation; SARS-CoV-2; Angiotensin-converting enzyme 2; TMPRSS2
서 론
사스-코로나바이러스-2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) 감염에 의한 코로나바이러스감염증-19(corona virus disease 2019, COVID-19)이 2019년 12월 중국 우한시에서 처음으로 보고된 이후 현재까지 전세계적으로 유행하고 있다.1) COVID-19 환자들은 기침, 피로감, 발열 등의 호흡기 감염증상을 주로 호소한다. 대부분의 환자들은 폐렴 없이 가벼운 상기도 감염의 증상만을 호소하거나, 가벼운 폐렴의 징후를 보였다가 자연스럽게 회복되지만, 14% 정도에서는 중등도 이상의 폐렴이 발생하며, 5%정도에서는 급성호흡부전 증후군까지 진행되는 경우도 있다.2,3)
폐렴 외에도 COVID-19는 구강 통증, 구강 건조감, 궤양, 구강 내 출혈성 반점 등의 다양한 구강 증상을 일으킨다.4,5) 인플루엔자 바이러스 등을 포함한 상기도 감염을 일으키는 다른 바이러스와 구분되는 COVID-19만의 독특한 증상으로 미각이나 후각의 소실도 보고되고 있다. SARS-CoV-2에 의한 COVID-19 환자들의 초기증상이나 무증상 감염환자들의 절반이상에서 미각이나 후각의 소실이 나타난다.5)
SARS-CoV-2는 80-200 nm 정도의 크기로 바이러스 입자 표면에 존재하는 Spike glycoprotein(S protein)이 호흡기 점막에 존재하는 ACE2(angiotensin converting enzyme 2) 수용체에 결합하여 세포 안으로 들어가게 된다. 이때 TMPRSS2(transmembrane protease serine 2)가 SARS-CoV-2의 S protein을 활성화 시키는 역할을 한다. 따라서 ACE2와 TMPRSS2 수용체를 발현하는 세포들이 존재하는 조직들이 SARS-CoV-2의 감염경로이자 표적조직이 된다. 단일 세포 전사체(single cell RNA-sequence, scRNA-seq) 분석 기술을 통한 여러 연구들을 통해 인체 내 다양한 조직에서의 ACE2와 TMPRSS2 수용체의 발현 정도가 밝혀지고 있다.6,7)
이번 종설에서는 COVID-19에 의해 구강과 인후두, 타액선 등 이비인후과적 영역에서 발생하는 여러 증상에 대해 알아보고, 구강 내 여러 조직에서의 ACE2와 TMPRSS2의 발현 정도와 위치에 대한 분석을 통해 이비인후과적 증상이 발생하는 병리학적 기전에 대해서 알아보고자 한다.
본 론
구강점막병변
COVID-19에 감염된 환자들은 구강과 인두의 여러 위치에서 수포(blister), 궤양(ulcer), 미란(erosion), 반점(macule), 반(plaque), 점상출혈(petechial) 등 다양한 점막병변을 나타낸다.4,5) 환자들에 따라 구강 점막 전반에 병변이 나타나는 경우도 있고, 특정한 한 부분에만 국한해서 나타나는 경우도 있다. 혀(38%), 입술(26%), 구개(22%), 잇몸(8%), 협부점막(5%), 구인두(4%), 편도(1%) 순으로 발생한다고 보고된다.8) 일반적으로 COVID-19에 의한 증상 발생 5일에서 2주 후부터 구강점막 증상이 나타나서 짧게는 3일부터 길게는 4주까지 증상이 지속되다가 전신증상의 회복에 따라 자연스럽게 회복되는 경과를 보였다. 드물게 전신증상이 나타나기 전에 구강점막 증상이 먼저 나타나거나, 전신증상과 동시에 나타나는 경우도 있었다.4,9,10) 이러한 구강점막 병변은 대부분 통증이나 작열감, 소양감 등을 일으키지만, 30% 정도에서는 특별한 증상을 일으키지 않았다. 치료는 구강점막 병변의 양상에 따라 클로로헥시딘이나 니스타틴 가글, oral fluconazole, 스테로이드, 항생제, 항바이러스제 등 다양하게 처방되었다.8,4,9,10)
구강점막에 발생하는 증상과 징후의 원인에 대해서는 아직 정확하게 밝혀지지는 않았다. 전신적인 컨디션 저하에 따라 이차적으로 발생하는 경우도 있겠지만, 최근의 여러 연구들에 의해 SASR-CoV-2에 의한 구강점막의 직접적인 손상도 원인이 될 수 있을 것으로 여겨진다.11-14)
미각장애
미각과 후각의 저하는 COVID-19의 특징적인 증상으로 보통 진단되기 4일에서 7일 전부터 증상이 나타나며, 감염으로부터 치료가 된 후 1-2주 안에 대부분 증상이 소실된다.9,10) COVID-19 환자들에서도 인후통 등은 흔하게 나타나지만, 이에 비해 비폐색이나 비루 등은 아주 드물게 나타난다. 또한 구강이나 비강점막의 이상 없이 미각과 후각의 저하가 나타난다.4) 이러한 점은 일반적인 바이러스성 상기도 감염을 앓은 후 미각과 후각장애가 나타나는 것과는 다른 경로를 통해서 증상이 발생하는 것임을 나타낸다. 초기에 제시된 미각장애의 원인으로는 SARS-CoV-2가 미뢰세포들을 직접적으로 침범하거나, 고삭신경(chorda tympani)이나 설인신경(glossopharyngeal nerve)과 같은 미각을 담당하는 신경의 침범, 또는 COVID19에 의한 국소적 또는 전신적 면역 반응에 따른 이차적인 구강 상피 세포의 손상 등이 있다.11)
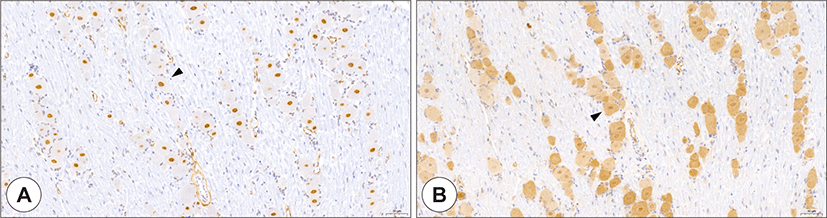
SARS-CoV-2가 미뢰세포를 직접적으로 침범할 수 있는가에 대한 것은 약간의 논란이 있었다. 비교적 초기에는 단일 세포 전사체 분석 기술을 통한 한 연구에서 SARS-CoV-2의 세포내 침입 통로가 되는 ACE2가 맛을 느끼는 것과는 직접적인 관계가 없는 사상유두(filiform papillae)에는 풍부하게 존재하지만, 미뢰가 있는 용상유두(fungiform papillae)에는 존재하지 않는다는 연구결과를 보고하면서 미각장애의 원인으로 SARS-CoV-2가 미뢰세포는 직접적으로 침범하지는 않는다는 주장이 있었다.11) 하지만 이후 인간과 쥐의 구강 상피 세포에서 ACE2를 조직학적으로 검출한 여러 연구에서 일부 미뢰세포에서 ACE2가 존재하는 것을 밝혀내었다(Fig. 1).12-14) 연구에 따라 미뢰세포에서의 ACE2의 발현이 다른 이유는 정확히는 알 수 없지만, 미뢰세포들로 분화되는 미분화 줄기세포들의 계통(cell lineage)에 따라 표현형(phenotype)이 다를 수 있을 것으로 생각된다.15) 한편, SARS-CoV-2가 미각을 담당하는 신경들을 직접적으로 침범하는 지에 대해서는 아직 직접적으로 밝혀지지는 않은 상태이다. 하지만, SARS-CoV-2가 이미 여러 신경을 침범하는 것으로 알려져 있으며, 구강내 촉각 및 통각을 담당하는 삼차신경절(trigeminal ganglion)에도 ACE2가 존재하는 것으로 미루어 볼 때, 고삭신경이나 설인신경을 직접적으로 침범할 수 있을 것으로 추정할 수 있다(Fig. 2).16-18)
Fig. 1.
Expression of ACE2 and TMPRSS2 in the papillae of the tongue. ACE2 staining (A, brown), and TMPRSS2 staining (B, brown). ACE2 and TMPRSS2 were not expressed in the basal layer, but the expression increased towards the mature keratinocytes in the suprabasal layer. ACE2- and TMPRSS2-positive cells were seen in the taste buds (arrowhead) of the tongue. ACE2: angiotensin-converting enzyme 2, TMPRSS2: transmembrane protease serine 2 (Bar = 50 μm).
Download Original Figure
Fig. 2.
Expression of ACE2 and TMPRSS2 in the trigeminal ganglion. ACE2 staining (A, brown), and TMPRSS2 staining (B, brown). ACE2 and TMPRSS2 were expressed in neuronal cell bodies (arrowhead), but not in Schwann cells. ACE2: angiotensin-converting enzyme 2, TMPRSS2: transmembrane protease serine 2 (Bar = 50 μm).
Download Original Figure
구강점막에서의 ACE2(angiotensin-converting enzyme 2)의 발현
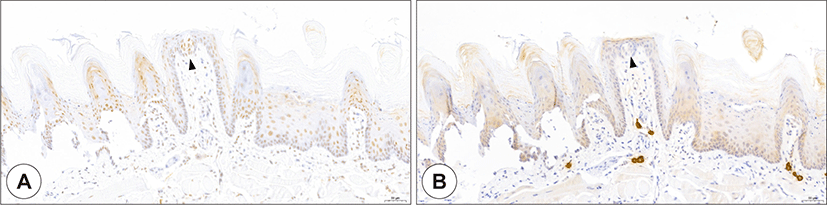
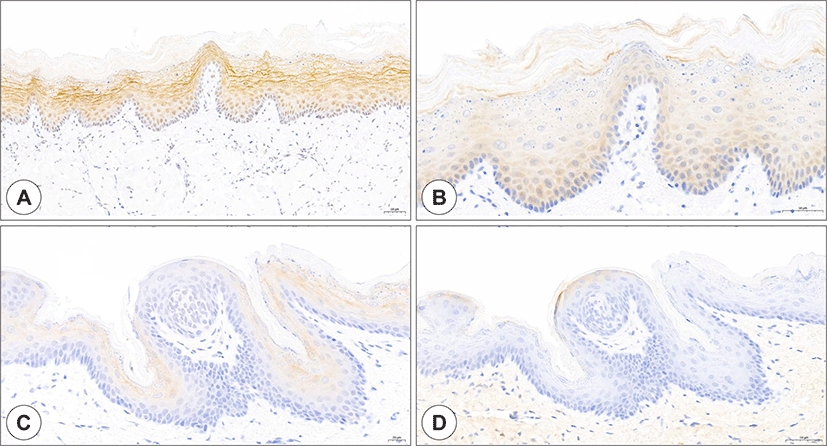
쥐와 인간의 구강점막 조직들을 조사한 여러 연구들에 따르면 미뢰세포를 포함한 혀, 구개, 협부점막 등 여러 구강내 조직들에 ACE2가 존재한다(Fig. 3).12-14) 구강상피 조직 중 줄기세포의 특성을 가지고 있는 미분화세포들이 존재하는 기저층(basal layer)에는 ACE가 존재하지 않으며, 기저층에서 각질세포로 분화되기 시작하는 세포들로 이루어진 중간층(intermediate layer)에 대부분의 ACE2가 존재한다. 또한 ACE2와 함께 SARS-CoV-2의 감염에 중요한 역할을 하는 TMPRSS2도 구강상피 조직의 중간층과 표면층(superficial layer)에 넓게 분포하고 있다. SARS-CoV-2 감염으로부터 회복된 후 1-2주 후에 미각저하가 회복되는 것은 미뢰세포의 재생기간(turn over)과 관계가 있을 것으로 생각된다.19,20) 줄기세포의 역할을 하는 미분화세포들이 존재하는 기저층에는 ACE2가 존재하지 않기 때문에 SARS-CoV-2가 침범하지 못한다. 따라서 SARS-CoV-2로부터 회복이 된다면 기저층에서 미뢰세포로 새롭게 분화되는 10일 정도의 시기가 지나면 미각기능이 회복될 수 있을 것으로 생각된다.
Fig. 3.
Expression of ACE2 and TMPRSS2 in the oral mucosa. ACE2 staining (A and C, brown) and TMPRSS2 staining (B and D, brown) of buccal mucosa (A and B) and soft palate (C and D). In the buccal mucosa, ACE2- and TMPRSS2-positive cells were more abundant in the intermediate layer than in the basal and superficial layers. Unlike the tongue epithelium, the expression of ACE2 and TMPRSS2 was in the basal layer. Soft palate mucosa, unlike tongue and buccal mucosa, showed weak expression of both ACE2 and TMPRSS2 in a few superficial keratinocytes. ACE2: angiotensin-converting enzyme 2, TMPRSS2: transmembrane protease serine 2 (Bar = 50 μm).
Download Original Figure
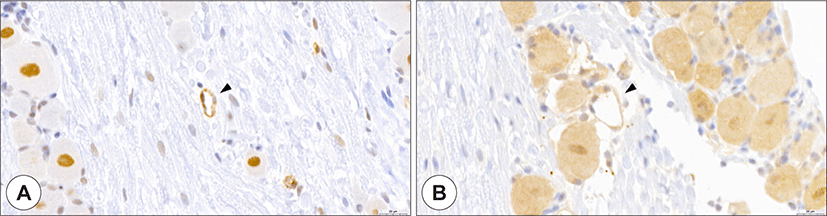
SARS-CoV-2는 미세혈관에 영향을 주어 혈관염, 미세혈전증, 울혈 등을 일으킨다.21) SARS-CoV-2에 의한 미세혈관의 손상은 조직으로의 저산소증과 염증을 일으키고, 결국 조직의 손상을 가속화 시킨다.22) 구강점막에 존재하는 모세혈관에서도 ACE2와 TMPRSS2가 강하게 발현이 되며, 이는 구강점막에서 발생하는 다양한 병변들의 원인으로 작용할 것으로 생각된다(Fig. 4).
Fig. 4.
Expression of ACE2 and TMPRSS2 in capillary. ACE2 (A, brown) and TMPRSS2 (B, brown) were strongly stained in the capillaries (arrowhead). ACE2: angiotensin-converting enzyme 2, TMPRSS2: transmembrane protease serine 2 (Bar = 50 μm).
Download Original Figure
SASR-CoV-2의 표적조직과 감염원으로서의 침샘
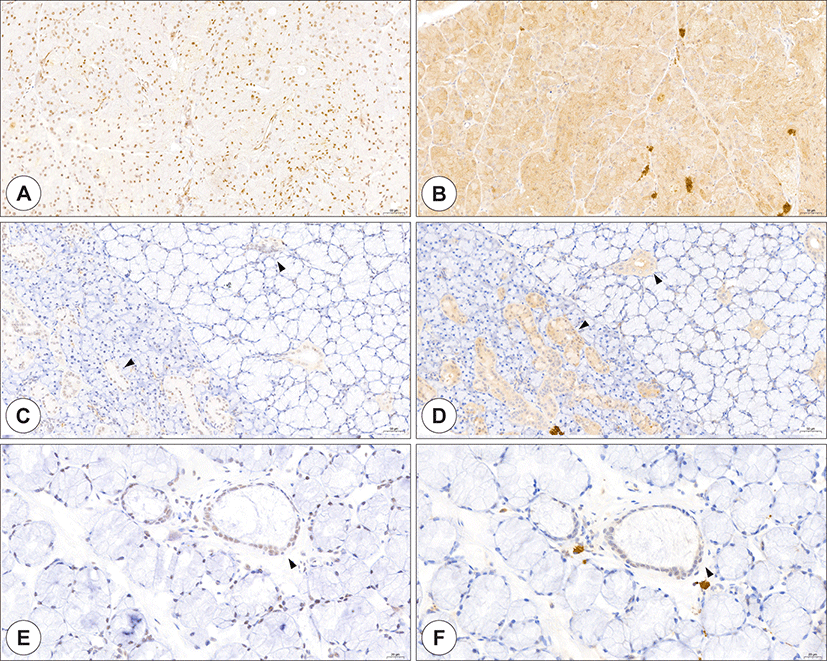
Paramyxovirus나 mumps 외에도 enterovirus, influenza, human parainfluenza viruses, adenovirus, cytomegalovirus, coxsackie, and Epstein-Barr virus 등 다양한 바이러스들이 급성 타액선염을 일으킨다.23) 이 바이러스들은 구강 내로 연결된 타액선관을 통해 역행하여 타액선을 감염시킨다.24, 25) SARS-CoV-2에 의한 타액선의 감염도 여러 증례보고를 통해 알려지고 있다. 주로 이하선염이 대부분이지만, 악하선의 감염도 보고되었다.26) 일부 타액선염으로 보고된 환자중 이하선 내에 위치한 임파선의 염증으로 이하선의 종창 및 압통을 호소한 경우도 있었지만, 대부분은 이하선 실질내의 염증 소견을 보였다. 이러한 다양한 침샘염의 보고와 함께 OVID-19 환자들의 절반 이상의 환자들에서 구강건조증을 호소하며, 타액에서도 SARS-CoV-2가 검출되는 것으로 봐서 이하선을 비롯한 여러 타액선들이 SARS-CoV-2의 표적조직이 될 수 있음과 동시에 감염된 타액을 만들어낼 수 있는 저장소가 될 수 있다고 비교적 초기부터 생각되어 왔다.27) 이에 따른 후속 연구들을 통해 이하선을 비롯한 주타액선과 구강, 구인두에 위치한 소타액선들의 선포세포(acinar cell)들에 ACE2와 TMPRSS2가 풍부하게 존재하는 것을 조직학적으로 규명하였으며, 또한 타액선관의 전장에 걸쳐 ACE2가 존재하는 것으로 보아 다른 바이러스와 같이 구강에 위치한 타액선관을 통해 역행 감염이 될 수 있음이 밝혀졌다(Fig. 5).28,29)
Fig. 5.
Expression of ACE2 and TMPRSS2 in the salivary gland. ACE2 staining (A, C, and E, brown), and TMPRSS2 staining (B, D, and F, brown) in the parotid (A and B), submandibular (C and D), and minor salivary glands (E and F). Both ACE2 and TMPRSS2 were strongly expressed in all salivary gland ductal cells (arrowhead). In the acinar cell, ACE2 and TMPRSS2 were strongly stained in the parotid gland, whereas ACE2- and TMPRSS2-positive cells were sporadically present in the submandibular and minor salivary gland(Bar = 50 μm). ACE2: angiotensin-converting enzyme 2, TMPRSS2: transmembrane protease serine 2.
Download Original Figure
결 론
SARS-CoV-2는 일부 미뢰세포를 침범하여 미각저하를 일으킨다. 또한 미각신경의 직접적인 침범 가능성도 배제할 수 없다. SARS-CoV-2는 모든 구강 상피의 중간층을 중심으로 퍼져나가며 삼차신경절을 직접적으로 침범하고, 미세혈관 손상을 발생시켜 구강내 여러 증상을 일으킨다. SARS-CoV-2는 구강과 인두에 위치한 소타액선뿐 아니라, 이하선 같은 주타액선에도 직접적으로 침범하며, 이로 인해 급성 타액선염이 발생할수 있으며, 타액 감염을 통한 전염확산의 원인이 될 수 있다.